【lac I 基因与lac operator】
lac I基因是乳糖操纵子的一部分,它的表达产物为lac阻遏物,该阻遏物能够跟lac operator操纵区域结合,与启动子的末端发生重叠。这种结合阻碍了RNA聚合酶与启动子的结合与向下转录,使得下游基因的表达关闭。因此Lac I蛋白可以作为lac operator上游启动子的开关。当添加诱导剂IPTG(一种乳糖类似物,能够与Lac I蛋白结合使其构象变化,从lac operator上解离下来)之后,启动子重新开启表达。
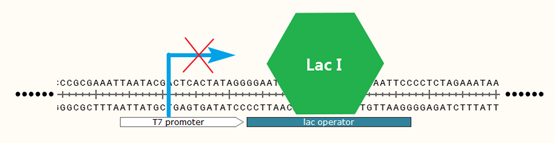
原始的乳糖操纵子中,lac operator上游启动子为lac启动子,而在pET-28a质粒中则为T7启动子,因此,这种阻遏对启动子的种类是不限定的,这也使得lac操纵子中的诸多元件被拆分并用于多种基因回路的构建中。
【核心表达区】
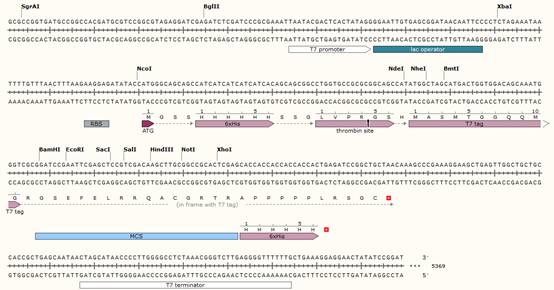
上图为pET-28a的核心表达区,主要组成部件有T7 promoter & terminator、lac operator、6×His、Thrombin site、T7 tag以及MCS区域。下面将分别介绍几个元件的功能。(想要做出上面这样酷炫的序列图?度娘snapgene或持续关注生工生物微信号对于该软件的安利)
【T7 promoter & terminator】
T7启动子是来自于T7噬菌体的,能够对T7 RNA聚合酶有特异性反应的强启动子,是启动T7噬菌体基因转录的一段序列。强大的T7启动子完全专一受控于T7 RNA聚合酶,而高活性的T7 RNA聚合酶合成mRNA的速度要比大肠杆菌RNA聚合酶快5倍。因此T7启动子和T7 RNA聚合酶系统成为大肠杆菌表达系统的主流。

【6×His】
6×His是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。在pET-28a载体中,可以通过不同酶切位点的选择,达到N、C双端标签、仅N端标签、仅C端标签及无标签等集中标记形式。
His标签有很多优点,一是能构成表位利于纯化和检测,如表达带有His标签的蛋白却没有相应抗体来检测,此时可以选择His标签抗体进行间接检测;二是His标签构成独特的结合配体利于纯化。组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。此外,His标签非常小,仅0.84kD,不会影响目标蛋白的功能。
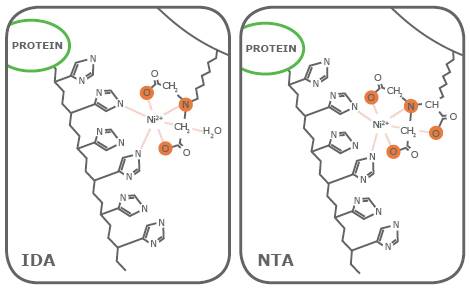
镍柱与标记His tag蛋白的结合
图片来源于Dr. Roland Fabis
【Thrombin site】
Thrombin site在pET-28a中的蛋白序列为LVPRGS,是典型的凝血酶的识别和切割位点。使用凝血酶处理表达的蛋白,可将融合蛋白中目的蛋白与非目的蛋白的肽段分离,然后用p-氨基琼脂糖从切割产物中将凝血酶纯化除去。
【T7 tag】
T7 tag是一种表位标签,由T7噬菌体基因10的前导序列编码的11肽组成,序列为MASMTGGQQMG。该表位标签能够被T7 tag标签抗体识别,可用于标记和检测蛋白,适用于免疫印迹、免疫沉淀和免疫染色技术。由于其体积小,基本不会影响标记蛋白的生化特性。
到这里,pET-28a上的基因元件就介绍得差不多了,还剩下MCS多克隆位点,但如何选择MCS中的几个限制性内切酶识别位点,才是构建表达载体的技术核心!

本文由生工生物编写,转载请标明出处。

