生工技术 | gRNA筛选和病毒包装感染目的细胞系
之前小编介绍了CRISPR Cas9 基因敲除sgRNA设计和载体构建(sgRNA设计)。设计好的sgRNA还需要实验验证其有效性,保证gRNA可以工作后,然后将含有gRNA和Cas9基因的载体导入细胞,在gRNA的引导下,Cas9蛋白实现精准的基因编辑。这一期,主要介绍gRNA的筛选和通过慢病毒载体实现gRNA/Cas9细胞导入。
gRNA筛选方法
一般我们会设计三条gRNA,gRNA设计好后,通过体外转录将gRNA转录出来,然后在体外gRNA的引导下Cas9蛋白定向切割目的基因。具体的操作流程是利用人工表达的Cas9蛋白和体外转录的gRNA,定向切割从基因组扩增出的编辑序列,最后通过琼脂糖凝胶电泳分析结果。
1.1 sgRNA体外转录
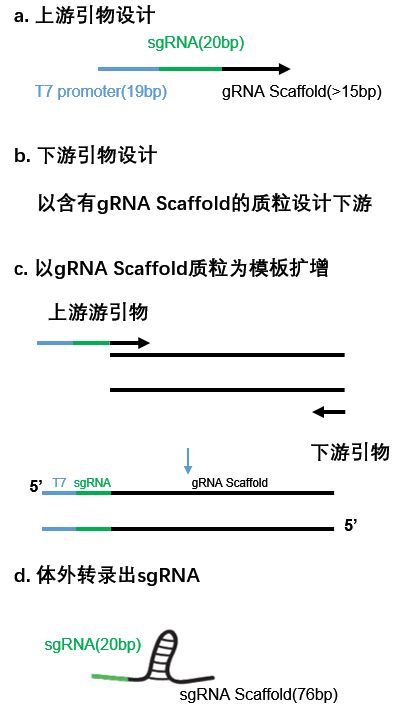
1.2 sgRNA引导的Cas9定向切割
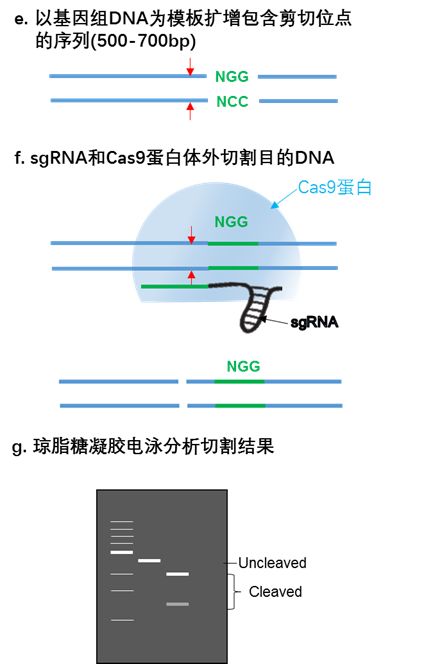
上述Cas9蛋白可以通过表达纯化获得,目前市面上已经有成熟的体外转录验证sgRNA有效性的试剂盒。具体的操作可以根据试剂盒操作说明。
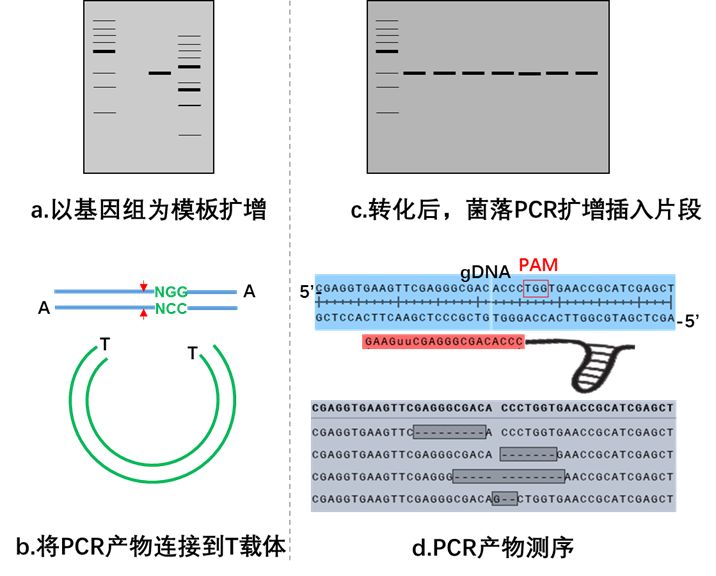
将表达Cas9和sgRNA的质粒瞬时转染至目的细胞系进行基因编辑,转染48 h后便可以抽提细胞基因组DNA,然后以基因组DNA为模板扩增包含剪切位点的序列(500~700bp),将PCR产物连接到T载体,转化后进行菌落PCR扩增插入片段,测序分析,确认编辑序列。
gRNA/Cas9细胞导入
确定gRNA有效性后,便可以进行后续的基因编辑实验。
gRNA/Cas9可以通过多种手段导入目的细胞系,这部分主要介绍利用慢病毒感染目的细胞系,进行目的细胞的基因编辑。
慢病毒表达包括病毒质粒构建、共转染293T细胞、收集浓缩病毒液、感染目的细胞系。为了产生安全高滴度的慢病毒,目前常用的慢病毒包装采用三质粒表达系统和四质粒表达系统。下面以构建好的CRISPR敲除载体为例,介绍三质粒包装慢病毒并且感染目的细胞系实现目的细胞基因敲除。
-
准备已经构建好的敲除质粒(sgRNA plasmid)、包装质粒(REV)和包膜质粒(VSVG)。
-
将上述三质粒共转染293T细胞, sgRNA plasmid:VSVG :REV=5:3:2。不同包装系统选择的载体和比例都不同,此系统只作为参考。
-
293T细胞培养48h后收集病毒液,存在在-80℃。
-
继续培养24h后,收集病毒液,将两批病毒混合,浓缩、检测病毒滴度。
通过质粒上的抗性基因筛选侵染成功的细胞pool,通过流式细胞仪筛选出含有GFP绿色荧光的单细胞,扩大培养。
可以提取基因组DNA扩增测序,或利用western blot实验验证目的基因在细胞系的敲除情况。确证的稳定敲除细胞系便可用于后续功能实验。
生工生物可以帮客户包装多种类型的病毒,欢迎咨询。

