生工技术 | SNP的检测技术——直接测序法&PCR-RFLP 酶切法
生工技术 | SNP的检测技术——直接测序法
PCR-直接测序法,顾名思义,提取出基因组之后,设计扩增引物,对目的SNP位点的上下游片段进行直接PCR扩增、将扩增产物进行ABI 3730xl 测序,通过测序峰图,就可以判断出片段的基因型。
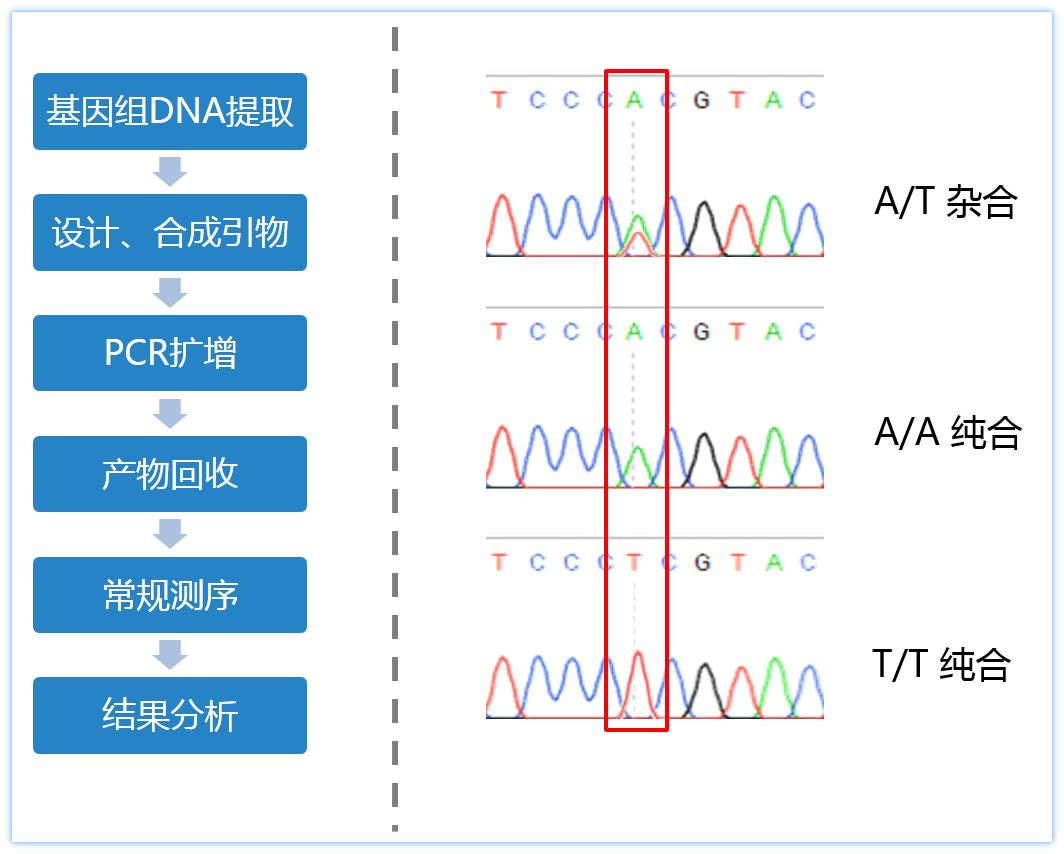
如上图所示,杂合型SNP位点的测序峰为套峰,在红框处显示,该位点有A和T的峰,重叠分布在这里。而纯合型SNP位点的测序峰为单一峰型,因而很容易将其区分开来。需要注意的是,这种分析方法,只能通过AB1峰图文件,找到对应的位点进行判断,而不能通过seq序列文件去判断。

PCR-直接测序法的最大优点是准确性高,SNP检出率接近100%。但是这种方法的样本通量很小,每个测序只能针对一个样本,从而间接提高了检测每个SNP位点的成本。
如果在一个测序的有效读长,通常是700bp以内,有多个SNP位点时,可以通过一次测序检出多个SNP位点,这样平摊到每个SNP位点上的成本才会降低。
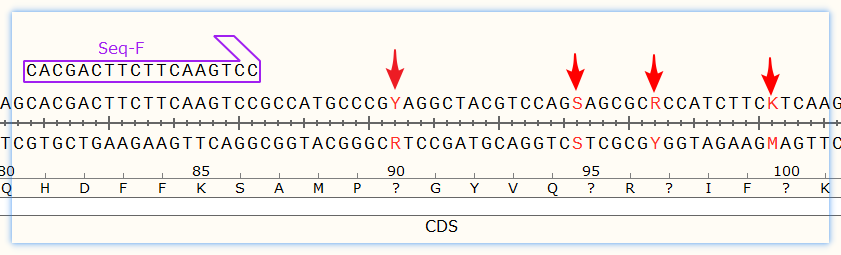
多个SNP在同一有效读长范围内
生工技术 | SNP的检测技术——PCR-RFLP 酶切法
所谓RFLP,是指限制性内切酶片段长度多态性,即不同序列的DNA,经过限制性内切酶的切割之后,产物会呈现不同的DNA片段大小。
那么SNP是如何改变这种多态性的呢?有一些SNP位点,正好是某一种内切酶的识别位点,如下图所示,当SNP位点为A/A纯合子的话,其所在的区域恰好会形成EcoRI的酶切位点,而当基因型为TT纯合时,该酶切位点被完全破坏。当基因型为杂合时,DNA序列中一部分被破坏而另一部分仍保留了这个酶切位点。
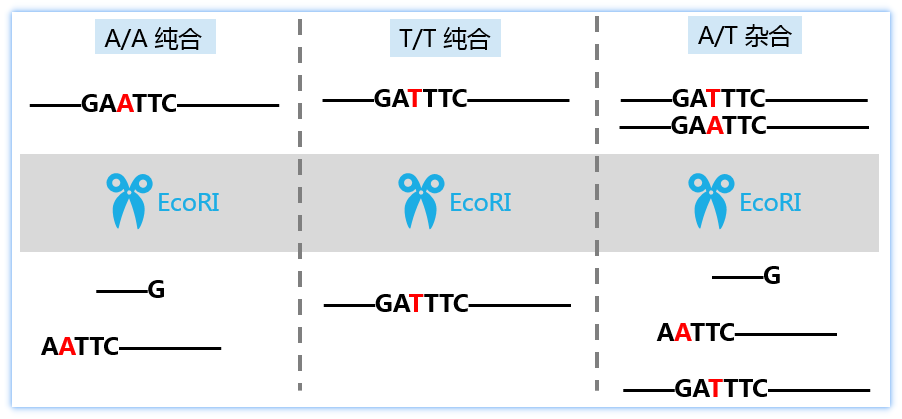
这样,当使用EcoRI内切酶对PCR片段进行酶切时,AA纯合被完全切成了两条短链,TT纯合完全不会被切断,而杂合既有切断的短链也有原始的长链。不同的基因型,经过酶切之后,在产物电泳时会呈现完全不同的带型,即呈现出了明显的RFLP多态性。
PCR-RFLP 酶切法的操作流程与测序法非常相似,设计引物扩增提取出来的DNA,片段回收之后直接进行酶切、酶切产物电泳,根据电泳条带进行结果的分析。
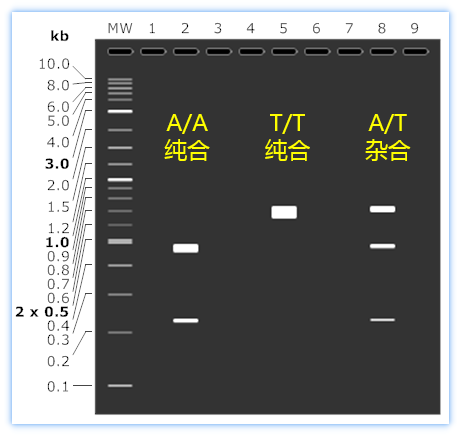
从电泳图中我们能够看得出,RFLP方法的结果分析非常直观,立刻就能判断出该样本的基因型。
并且,可以对多个样本配制多个反应体系,然后一起电泳分析,因此这种方法对样本的通量还是比较大的。
但是如果有多个SNP位点需要分析,很有可能需要使用不同的内切酶,重新酶切,因此,这种方法对位点的通量比较低,并且检测的SNP需要有合适的酶切位点存在才可以,并不是所有的SNP位点都适合这种方法。

