对于DNA来讲,多种维度都可以作为Oligo的量的描述。具体有:
-
重量(质量),如30 ug、100 mg等,重量是对DNA的量最直接的描述之一;
-
摩尔数,描述的是oligo的数量,如5 nmole、1 μmole等,通过阿伏伽德罗常数可以换算出具体的条数;
-
OD数,描述的是1ml Oligo溶液在260nm处的吸光值。如1 OD,100 OD等。
2. DNA的定量方法
目前最主流的定量方法,就是使用NanoDrop等微量核酸定量仪,或者分光光度计,通过检测DNA的260nm处的吸光值,换算为ng/μl的数值。(另外一种是根据核酸染料的荧光值来定浓度,不在本文的讨论范围内。)
所以通过仪器检测,我们会得到两个对于定量来讲最重要的数值,分别是A260(260 nm处的吸光值),和质量浓度ng/μl值。对于不同种类的DNA,这两个数值有的准确,有的不准确。
DNA的种类,在这边大致分为两种:一种是天然的或人工合成的长的单链/双链DNA,通常不带有修饰,比如提取的基因组DNA,质粒DNA,胶回收产物等;另一种是短的,化学合成的单链DNA,通常被称为Oligo,比如引物、探针等。
对于上述这两种DNA,其最适合描述它们的量的维度是不同的。
3.1 质量浓度ng/μl——适用于长的单/双链核酸:
质量浓度通常适合描述第一种长链DNA,因为其序列比较长,ATCG占比比较平均,260 nm吸收光的能力被平均化了,对于单链DNA,大致为1 OD对应33 ug,而对于双链DNA,大致为1 OD对应50 ug。比如质粒,当我们用NanoDrop检测一管质粒的浓度时,仪器会直接给出数值,比如100 ng/μl。
这个值是如何得来的呢?是仪器计算出溶液的OD值(即A260吸光值),然后通过“1 OD对应50 ug”这个参数,将其换算成了ng/μl的数值。
但是如果检测的是短的单链DNA,这个ng/μl就不那么准确了,需要使用A260吸光值来换算其真正的质量。
3.2 A260吸光值——适用于短的或带有修饰的核酸:
对于短的核酸如oligo来说,每个碱基的吸光性质对整条序列的影响都非常大,并且ACTG四种核苷酸的吸收光谱能力是不同的,最大的吸收值也在255~280nm范围内,不是准确的260nm处。所以对于Oligo来讲,A260吸光值与序列核苷酸种类的组成以及上面的修饰(尤其是荧光类的)密切相关,吸光值与质量的关系已经不是1 OD对应33 ug了。
比如对于序列A18(AAAAAAAAAAAAAAAAAA),如果按照常规的定量,A260=1时,其体现出的质量浓度为33ng/μl。而实际上,A260=1时的准确质量浓度为25.41 ng/μl。
因此,对于Oligo的定量,不能直接使用仪器给出的ng/μl数值,为了保证得到准确的定量结果,需要根据oligo来进行摩尔消光系数的定制化设置,通过A260的数值,进行摩尔浓度的换算。
使用的换算方法,称为朗伯比尔定律(Lambert-Beer law),公式非常简单:
Oligo溶液浓度(μM)= A/E*1000000
其中A是oligo溶液在260nm处的吸光值,E是oligo的摩尔消光系数。
摩尔消光系数(ε260)是指1摩尔寡核苷酸链水溶液在260 nm处的吸光值。该数值决定了寡核苷酸链质量与合成OD数的关系。组成碱基种类随机且平均的情况下,可以近似认为DNA双链1 OD的量为50 μg,单链寡核苷酸1 OD的量为33 μg。但对于客户定制的寡核苷酸链,需要根据序列进行计算。
举个例子:对于序列TTTTTTTTTTTTTTTCAAGGCACGTCCCAGACGCATCAA(摩尔消光系数E=355900 L/(mole·cm))的一管溶液,如果我们测得该溶液A=0.5,那么Oligo浓度(μM)= 0.5/355900*1000000=1.4,即溶液浓度为1.4μM。
5. 究竟该如何确定订单中的OD值?
也就是说,朗伯比尔定律将OD和摩尔数准确的关联到一起了。其关联关系是
nmole = OD / E * 1000000
还是举上面的例子,对于序列TTTTTTTTTTTTTTTCAAGGCACGTCCCAGACGCATCAA(摩尔消光系数E=355900 L/(mole·cm)),如果我想合成100nmole,那么
100 = OD / 355900 * 1000000
可以计算出OD=35.59,那么我们提交合成订单时,OD量写成36就行了。
6. 如何确定产品管中的量是否准确?
很多人会使用微量核酸定量仪(如NanoDrop仪器)判断一个产品管中的定量是否准确,方法非常简单,可以用下面这个公式进行快速计算:
理论A260 = 该管中的OD数 * 1000 / 加水体积(μl)
例如,一管5 OD的Oligo,使用500 μl水溶解,那么使用NanoDrop测定其A260数值,应该等于5*1000/500 = 10。如果测得A260超过10,说明实际含量偏高,如果低于10,说明Oligo供应商给的量不足。相应的误差也能够轻松计算出来。
注意,切不可根据通用的参数进行ng/μl或mole数的换算,如果需要换算,请参考5中的公式。
可以发现,国内Oligo供应商通常都默认用OD作为订单的合成量维度,而不是nmole。这是因为使用OD来下单,对于生产和检测都比较方便,它体现的就是A260吸光值,可以直接通过仪器检测的A260来确定分装的体积。客户拿到溶液之后,也比较容易通过核酸定量仪来确定产品的量是否足够,比如,如果客户订购15 OD/管的oligo,使用1 ml水溶解之后,其A260吸光值就是15;1 OD/管的oligo,使用1 ml水溶解之后,其A260吸光值就是1,非常好检测。
但这样会有一个弊端,就是无法直接体现订单的nmole数,必须通过合成报告单中的结果去进行查询,比如下图中的案例:
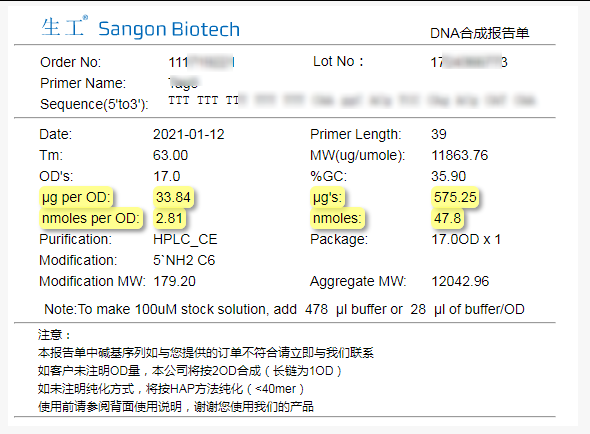
其实,国外很多公司都是可以直接用nmole作为合成量的,生工也在合成单中提供了以nmole量为维度的选择。
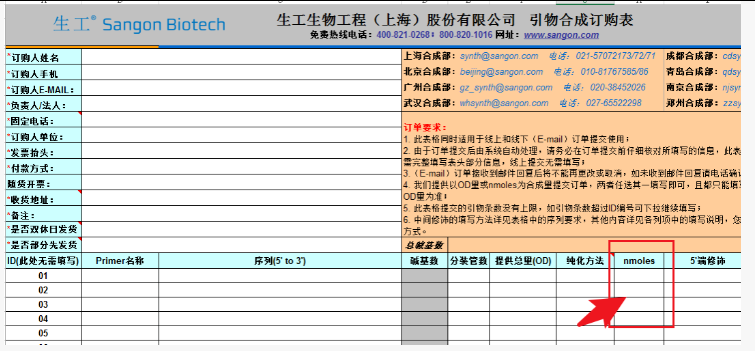
如果在需要订购一定摩尔数的Oligo时,如果不方便换算成OD,那么也可以直接在nmoles中进行填写。
8. 摩尔消光系数到哪里计算?
可以在这里计算:https://www.sangon.com/baseCalculator,将序列和修饰输入进去,点击计算,就能得到所需要的结果:
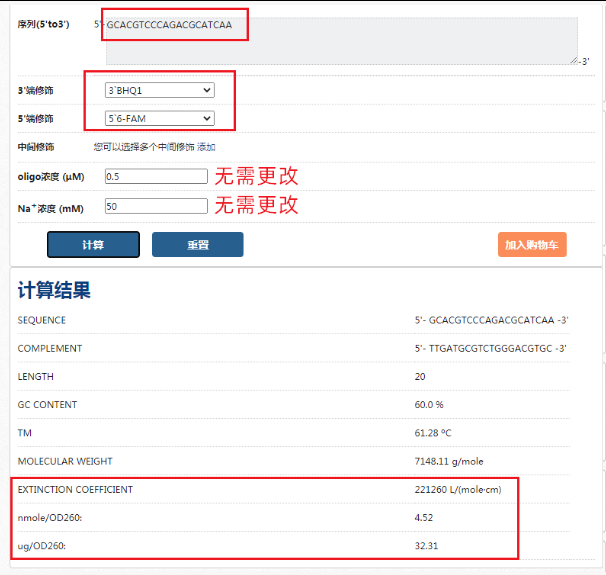
生工引物分析器采用最近邻二态模型进行消光系数的计算,参考数据为Michael于2003年发表于《Nucleic Acids Research》的文章(DOI: 10.1093/nar/gnh015)。是目前行业中比较准确的,而且目前绝大多数公司都是采用的这个算法。
.png)

