胶体金的制作
胶体金是一种在免疫学和材料学常用的原料。为了认识胶体金,首先我们来了解下什么是胶体。胶体一种较均匀的混合物,在胶体中存在两种不同状态的物质,其一为分散剂,比如水。另一种为分散质,就是金纳米颗粒。分散质金纳米颗粒的直径在1-100 nm之间。这个直径大小比溶液中分子量的直径要大不少。
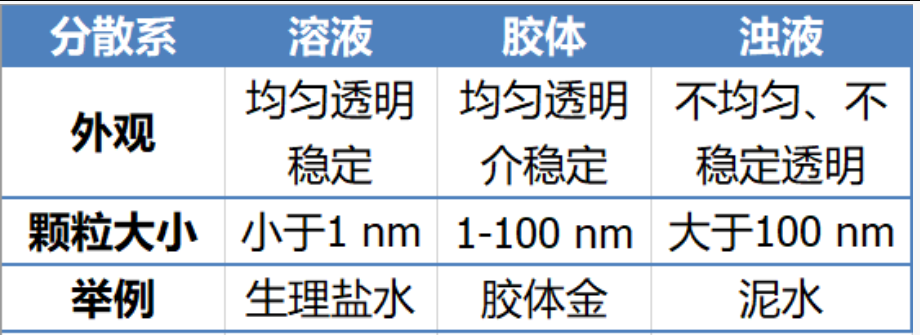
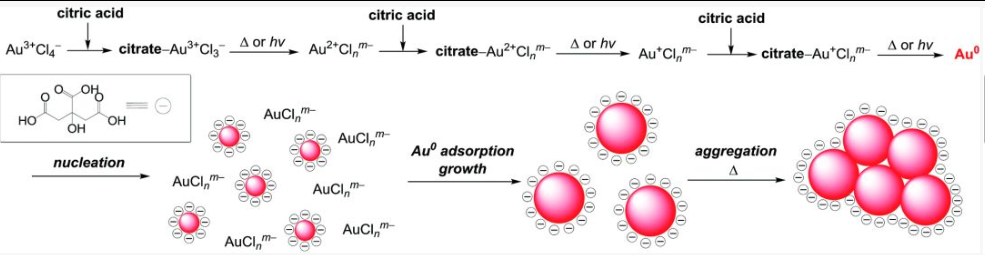
胶体金的原料则是氯金酸HAuCl4,氯金酸在水中会形成溶液状态,颗粒大小低于1 nm,那么氯金酸分子是怎样形成颗粒较大的胶体金的呢?这要从胶体金的制备过程说起:取0.01 %的氯金酸100 ml加热至煮沸,然后加入一定量的1% 柠檬酸三钠溶液。持续进行加热,一开始为蓝色,后续转化为红色,5 min后开始形成透明的红色胶体金溶液[1]。

在这个过程中,三价的金离子被还原成零价的金原子,被称为Au Seed,我这里翻译成种子金。种子金的作用就像人工降雨里的碘化银凝结核,所不同的是,碘化银吸收的是水,而种子金吸收的是未进行还原的的柠檬酸分子[2]。
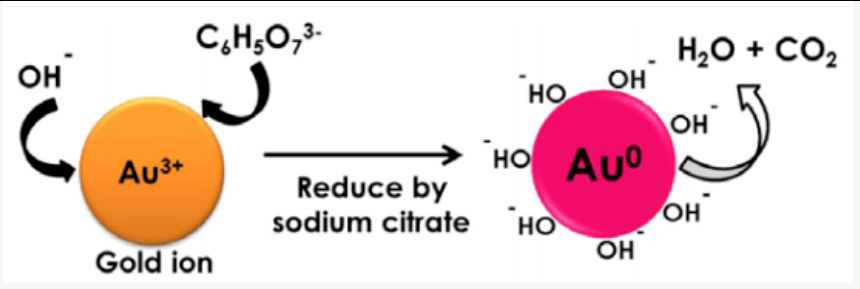
柠檬酸分子上的羧酸电离后带有负电,除了能与种子金形成化学键,还可以与未被还原的氯金酸中的金原子形成化学键[3]。
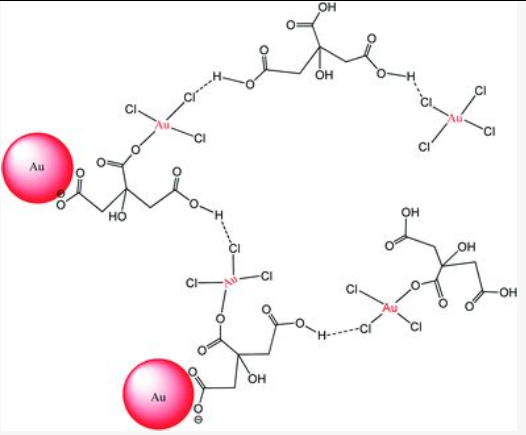
多个金原子之间通过化学键紧密的结合到一起。开始形成金原子簇,最后联合成为金纳米颗粒[4]。
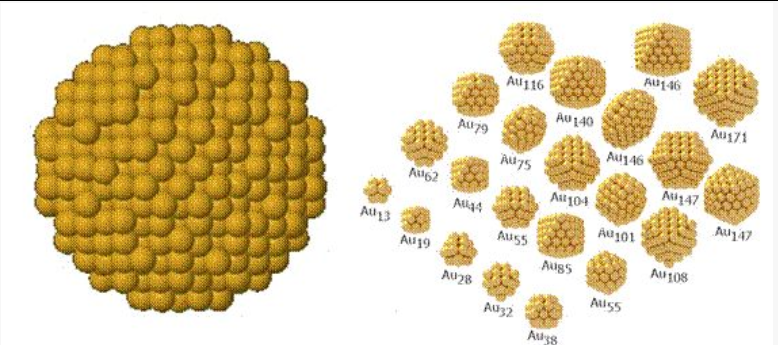
下图左侧的照片的展示要更直观一些,所谓的胶体金并非是单独的一个金原子,而是由多个金原子以及柠檬酸的聚合物。这些金原子颗粒的数量肉眼看过去也比较舒适,不至于产生密集恐惧症。除了球状的的金纳米颗粒,金纳米颗粒也可能形成下图右侧中的形状。这些形状是计算机模拟不同金原子数量的金纳米颗粒的结果[5],不少看起来像是魔方或是骰子,甚至可以联想为桑葚,大概小编已经饿了。
完成了上述胶体金的制备过程,怎么样去判断已经得到了成功的胶体金呢,有下面两种方案。第一种办法比较简便,即通过丁达尔现象来进行观测。所谓丁达尔现象,是当一束光线透过胶体,从垂直入射光方向可以观察到胶体里出现的一条光亮的“通路”。这是由于光在金纳米颗粒的表面发生散射的结果,而在黄色的氯金酸溶液中,由于氯金酸颗粒较小,散射作用较弱,不容易被观察到。

第二种办法则需要借助大型仪器投射电子显微镜(TEM),这种办法不仅能直接观察到金纳米颗粒的存在,还能确定金纳米颗粒的大小[6]。实际上,金纳米颗粒的大小和加入还原剂柠檬酸钠的量有关系,在保持氯金酸加量不变的前提下,柠檬酸钠加入的越多,所形成的金纳米颗粒越小。柠檬酸钠加入的越少,所形成的金纳米颗粒越大。小编这里的理解是,因为体系中加入氯金酸的量是固定的,越多的还原剂可以形成更多的种子金,产生更多的金纳米颗粒中心(“山头”),这样最后形成的金纳米颗粒大小也就越小。而越少的金纳米颗粒中心(“山头”)就能够吸引更多的金原子,产生更大的金纳米颗粒。

不同颗粒大小的胶体金都带有颜色,这个颜色的产生是由于胶体金吸收了可见光中的一部分造成的。我们把金纳米颗粒想象成下图中的黄色球体,而金纳米颗粒中的电子则位于球体的表面。金纳米颗粒的大小远小于可见光的波长(400-760 nm),这些电子在入射光产生的电场的影响下朝着相反的反向进行振动。当光线照射到金纳米颗粒表面时,如果入射光的频率和金属纳米颗粒表面电子震荡的频率相同时,就会产生共振。金纳米颗粒对入射光产生很强的吸收作用,这种现象被称为局域表面等离子体共振(LSPR,localized Surface Plasmon Resonance)[7]。等离子体就是我们刚刚提到的在金属表面的电子。
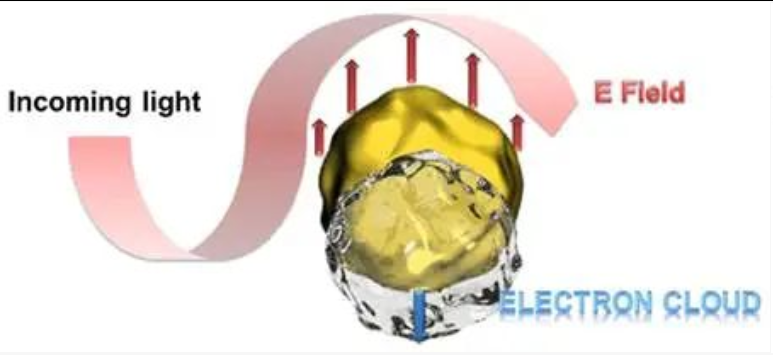
那么,是不是所有的金属表面都会发生局域等离子体共振呢?实际上,这个现象只存在于贵金属中,比如金,银,铜,铂和钯[8]。我们可以看到金纳米颗粒在可见光范围有较大的吸收范围,比较适合在可见光范围内进行检测。且银、铜容易被氧化形成氧化膜,影响局域等离子体共振的发生。而金不容易被氧化,相比银、铜更加稳定。
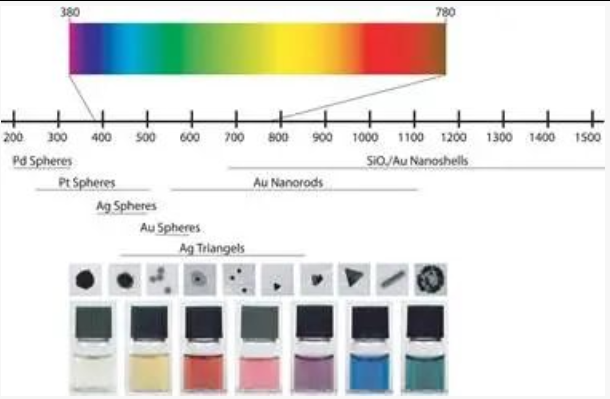
胶体金颜色会受到金纳米颗粒的大小的影响,随着金纳米颗粒大小的变大,它的最大吸收波长逐渐变大,外观颜色也从红色向紫色方向转移。下图中从左到右展示的是从4 nm到40 nm大小的金纳米颗粒颜色的变化[9]。从LSPR的原理上来说,金纳米颗粒越大,其表面电子距离核心的距离也就越远,变得更加容易发生震荡。震荡所需的能量越小,与入射光发生共振的光的频率也就越低,入射光发生共振的光波长也就越大。

胶体金与DNA的连接办法
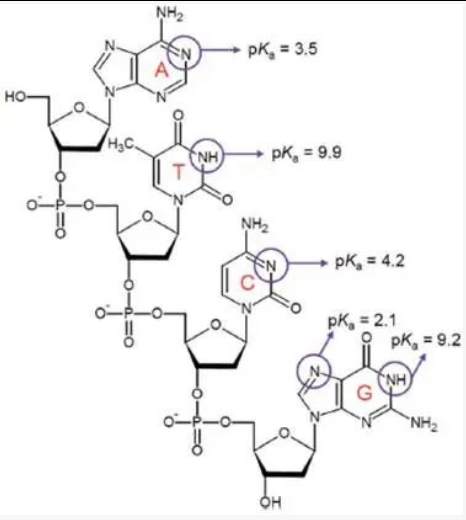
在具体讲述连接办法之前,我们先回顾下DNA的基本性质。下图显示的是5’- ATGC-3’的寡核苷酸,即使DNA上未进行任何修饰,金纳米颗粒AuNP也会对其产生强烈的吸附作用,吸附作用从强到弱分别为A> C> G> T >>磷酸。碱基在PH5到8之间呈现电中性,腺嘌呤A和胞嘧啶C在PH 3.5和4.2时会获得质子从而带一个正电,鸟嘌呤G在PH 2.1时才发生质子化,这都需要相当低的PH才会发生,而这样的PH在常规实验中是不会遇到的。通常情况下,DNA是带大量负电荷的聚合物[10]。
如果只是借助AuNP对DNA的吸附,通常情况下,会在DNA序列的一端带有PolyA的结构,PolyA负责与AuNPs的结合,其余部分序列参与杂交过程。大部分情况下,AuNP与DNA的连接过程是通过AuNP的DNA上巯基之间的金硫键来完成的。由于DNA和AuNPs都带负电荷,会受到金纳米颗粒的负电和DNA所带有的负电的排斥力影响,导致两者很难形成金硫键。
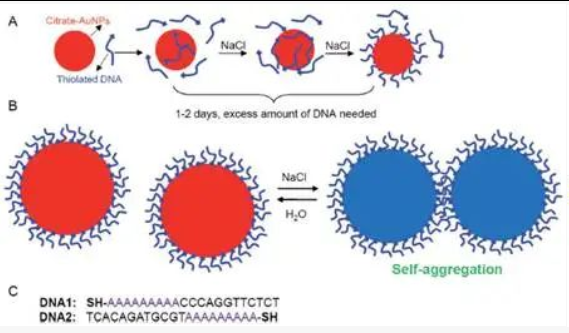
盐老化办法
(salt aging)
为了解决负电排斥力的影响,最好的方式就是在体系中加入带有正电的钠离子。这个方式和PCR体系中加入钠离子类似,两条互补单链DNA都带有负电,在体系中加入钠离子中和负电荷,便于两条互补单链DNA形成氢键,使得引物更容易结合在模板DNA上。同理,在AuNP交联应用中,正电的钠离子中和AuNP和DNA链上带有的负电荷。但如果一下把钠离子浓度提的太高(1 M),在AuNP和DNA形成金硫键之前,AuNP之间由于电荷消除的影响导致不可逆转的uNP聚集,溶液从红色变为蓝紫色,导致实验失败。最早进行AuNP研究的Mirkin实验室[11]的解决方案是这样:使用加盐老化(salt aging)的办法,逐步提高氯化钠的浓度。同时修饰FAM和巯基修饰的DNA在临用前,DNA之间的二硫键使用DTT进行还原,将含有DTT的溶液(0.1 M DTT, 0.18 M phosphate buffer (PB), pH 8.0)直接用于溶解DNA干粉。被还原的DNA使用NAP-5纯化柱(脱盐柱)进行纯化。刚还原的DNA加入到AuNP中(浓度1 OD/1 mL),并调节体系中PB和SDS的终浓度为为0.01 M和0.01% 。DNA和AuNP的混合物在室温下静置20 min,使用2M NaCl,0.01 M PB,0.01% SDS加入到这个混合物中,使得钠离子浓度提高到 0.05 M。静置20 min,接下来将混合物进行超声 10 s以分散纳米颗粒。然后再次加入2M NaCl,0.01 M PB,0.01% SDS溶液,重复加入NaCl使得体系中的钠离子浓度以0.1M的梯度进行上升,并最终达到1 M这个浓度。最后AuNP在室温下放置过夜。为了去除多余未连接的DNA,将AuNP进行离心并去掉上清,然后使用0.01 %的SDS进行重悬,清洗步骤共进行5次以彻底去除多余的未连接DNA。
在这个过程中,加入带有负电的DNA连接到AuNP上,实际上提高了AuNP对钠离子的稳定性,原始的AuNP只能耐受50 mM的NaCl,在连接了DNA之后,在1 M NaCl下也能保持稳定。盐老化的原理如上图A所示。最初,只有少数DNA分子通过硫醇基或某些碱基被吸附。这是可能的,因为总DNA密度非常低。这些最初吸附的DNA分子增加了AuNPs的负电荷密度,并排斥已经连接DNA的AuNPs,而不是裸AuNPs。AuNPs-DNA复合物的稳定性优于裸AuNPs。着添加更多的NaCl,更多的DNA被吸附,直到达到新的静电斥力平衡。这些新吸附的DNA分子进一步提高了耐受更多NaCl的能力。在这种盐老化过程中,巯基逐渐取代了吸附在AuNPs上的DNA碱基,从而使DNA站立起来。在该过程的后期,盐的主要作用是减少AuNP上DNA之间的排斥,从而可以实现超高密度。
盐老化过程中的常见问题
对于典型的成功实验,AuNPs的颜色在整个过程中应保持红色。有时AuNPs与DNA混合后立即聚集,甚至在不加盐的情况下。这说明DNA中存在杂质,可以使用Sep-Pak柱或其他方法通过脱盐步骤将其去除以纯化DNA。有时,AuNPs在盐老化过程中会变成紫色。在这种情况下,DNA介导的自聚沉是可能的。为了对此进行检查,可以将聚沉的样品离心以除去上清液,然后将其重新分散在纯水中。如果AuNPs可以完全恢复为与分散的AuNP相同的红色,这意味着DNA序列可以自我杂交。这对于颗粒较大的AuNPs尤其是个问题,因为它们具有更大的DNA相互配对的区域(上图B)。仅需要三到四个碱基对就能完成自我杂交的过程, 因此,需要仔细的序列设计以避免这种影响。例如,在上图C所示的两个序列中,DNA1对这种自聚沉具有抗性,而DNA2则倾向于这种自聚沉。然而,当以较低的盐浓度进行以抑制自聚沉时,这种AuNPs仍可用用于和DNA完成连接。只要保持盐浓度足够低(或在更高的温度下),这样就不会发生自聚集。
低PH下巯基DNA的连接
除了之前加盐老化使AuNPs与巯基DNA连接的办法,还有一种方案是在PH 3.0的柠檬酸溶液中进行纳米金颗粒与DNA的连接[12]。在下图中,首先将纳米金颗粒和DNA混合,但是不加入NaCl。将PH分别调解到7.6和3.0。然后加入0.3 M NaCl,可以观察到PH 7.6的那管颜色开始发紫,但是PH 3.0的那管依然保持鲜红。孵育3 min后,接下来将混合物分别离心,去掉上清,然后加入300 mM NaCl, 10 mM HEPES, pH 7.6,可以观察到初始PH 7.6 金纳米颗粒开始明显聚集。而初始PH 3.0的那管依然保持红色,即使把NaCl 浓度提高到1 M,颜色依然不变。这说明左侧的管中DNA没有与纳米金相连,因此它对钠离子的耐受性很弱。而右侧管中的DNA已经成功与纳米金相连,它可以耐受1 M的钠离子。

在纳米金颗粒上修饰DNA后,正常情况应该如上图的右侧那管一样,还是鲜红色。这是因为修饰DNA对纳米金颗粒的大小影响不大。以13 nm直径的纳米金颗粒为例,直径大约从13 nm提升到18 nm左右。
该方法的基础是DNA碱基的质子化。即,腺嘌呤和胞嘧啶可以在pH 3下被质子化。质子化的碱基减少DNA和AuNP之间的排斥,更重要的是,减少AuNP上DNA链之间的排斥。因此,如果DNA富含鸟嘌呤和胸腺嘧啶,则这种低pH值的方法不太可能奏效。
巯基DNA的还原预处理
生工提供商品化的巯基修饰DNA包含两种形式,游离硫醇(free thiol,修饰代码为SH CN)和二硫化物(disulfide,修饰代码为HS-SH CN)。游离硫醇修饰的DNA容易形成分子间二硫键导致二聚体。二硫化物修饰的DNA是巯基被保护的结构。为了得到裸露的巯基,在临用前需要使用还原剂DTT或者TCEP进行还原处理。
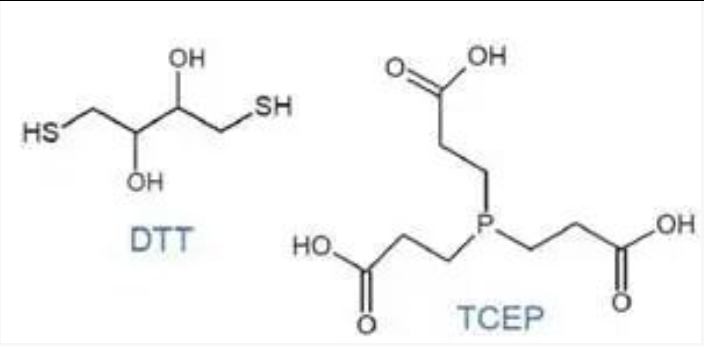
使用DTT的还原办法参考前文盐老化的章节,由于DTT本身也是含有巯基的分子,在于AuNP连接之前,需要通过脱盐柱等办法去除DTT。TCEP不含有巯基,因此使用TCEP还原的办法不需要去除TCEP,且TCEP对AuNP的亲和力不高。可将 200 μl 的15 μM的巯基修饰的DNA与 5 μl 的1 M 的TCEP混合,室温下还原30 min。后续可以直接与AuNP混合[13]。
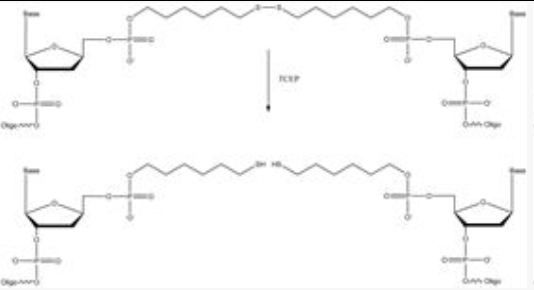
5'SH C6还原前后结构 5'HS-SH C6还原前后结构
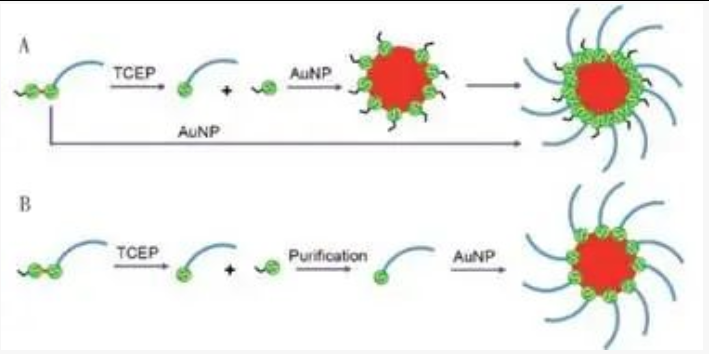
当使用TCEP还原二硫化物修饰的DNA,切割下来的保护剂碎片仍然残留下体系中,它也会吸附在AuNP上。在13 nm AuNP上,可以吸附1200个巯基。但是,由于DNA分子的空间位阻,它只能吸附100个DNA分子。因此,AuNPs上有足够的空间吸附切割下来的保护剂碎片(下图A)。对于完全裂解和纯化的DNA样品,与AuNP连接的性能可能会更好, 特别是对于那些难以连接的DNA样品(下图B) 。
巯基DNA的优化修饰
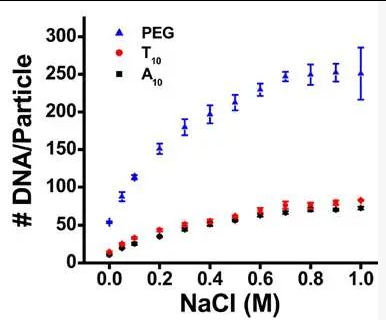
巯基与DNA之间可以通过增加空间的办法减少AuNP和DNA之间的空间位阻,最先使用的办法是通过加入一段重复的碱基, 由于AuNP对碱基的吸附能力从大到小为 A> C> G> T,通常使用PolyT提升空间距离。PolyT的碱基长度通常为10,将碱基长度从10提升到20,对DNA链与其它链杂交时的Tm值提高不大[14]。PEG修饰(对应生工的spacer 18)的DNA相比重复的碱基能提高AuNP上巯基修饰DNA的数量,这是由于PEG是电中性的,能够避免碱基与AuNP静电排斥作用[15]。Dithilol(DTPA)修饰含有两个巯基,在竞争性的硫醇如巯基乙醇或DTT存在的情况下,相比单巯基修饰AuNP复合物更稳定[16]。
参考文献:
-
Ahmad Alshammari, Angela Köckritz, Venkata Narayana Kalevaru, Abdulaziz Bagabas, Andreas Martin, Influence of Single Use and Combination of Reductants on the Size, Morphology and Growth Steps of Gold Nanoparticles in Colloidal Mixture. Open Journal of Physical Chemistry. Vol. 2 No. 4 (2012).
-
Rabizah Makhsin, Siti Razak, Khairunisak Abdul Noordin, Rahmah Dyana Zakaria, Nor Chun, Tan Soo, The effects of size and synthesis methods of gold nanoparticle-conjugated MαHIgG4 for use in an immunochromatographic strip test to detect brugian filariasis, Nanotechnology. 23 (2012) 495719 (13pp)
-
Weinan Leng,Paramjeet Pati and Peter J. Vikesland, Room temperature seed mediated growth of gold nanoparticles: mechanistic investigations and life cycle assesment, Environ. Sci.: Nano, 2015, 2, 440-453.
-
Yasuhiro Shiraishi, Haruki Tanaka, Hirokatsu Sakamoto, Satoshi Ichikawa and Takayuki Hirai, Photoreductive synthesis of monodispersed Au nanoparticles with citric acid as reductant and surface stabilizing reagent, RSC Adv., 2017, 7, 6187-6192.
-
AS Barnard, Modelling of nanoparticles: approaches to morphology and evolution, Reports on Progress in Physics 73(8):086502.
-
Suprit Deol, Nisala Weerasuriya and Young-Seok Shon, Stability, cytotoxicity and cell uptake of water-soluble dendron–conjugated gold nanoparticles with 3, 12 and 17 nm cores,J. Mater. Chem. B, 2015, 3, 6071-6080.
-
Michael Holzinger,Alan Le Goff,and Serge Cosnier, Nanomaterials for biosensing applications: a review, Front Chem. 2014; 2: 63.
-
Andrea Csáki Matthias Thiele Jacqueline Jatschka André Dathe David Zopf Ondrej Stranik Wolfgang Fritzsche, Plasmonic nanoparticle synthesis and bioconjugation for bioanalytical sensing, Engineering in Life Sciences:Volume15, Issue3Special Issue: Microfluidics,April 2015,Pages 266-275.
-
Vicky V. Mody, Rodney Siwale, Ajay Singh,and Hardik R. Mody,Introduction to metallic nanoparticles,J Pharm Bioallied Sci. 2010 Oct-Dec; 2(4): 282–289.
-
Biwu Liu and Juewen Liu. Methods for preparing DNA-functionalized gold nanoparticles, a key reagent of bioanalytical chemistry. Analytical methods 9(18):2633-2643.
-
Sarah J. Hurst, Abigail K. R. Lytton-Jean,and Chad A. Mirkin. Maximizing DNA Loading on a Range of Gold Nanoparticle Sizes. Anal Chem. 2006 Dec 15; 78(24): 8313–8318.
-
Xu Zhang, Mark R. Servos, and Juewen Liu. Instantaneous and Quantitative Functionalization of Gold Nanoparticles with Thiolated DNA Using a pH-Assisted and Surfactant-Free Route. J. Am. Chem. Soc. 2012, 134, 17, 7266–7269.
-
Liu J, Lu Y. Colorimetric Cu2+ detection with a ligation DNAzyme and nanoparticles. Chem Commun (Camb). 2007 Dec 14;(46):4872-4.
-
Abigail K. R. Lytton-Jean and Chad A. Mirkin. A Thermodynamic Investigation into the Binding Properties of DNA Functionalized Gold Nanoparticle Probes and Molecular Fluorophore Probes. J. Am. Chem. Soc. 2005, 127, 37, 12754–12755.
-
Sarah J. Hurst, Abigail K. R. Lytton-Jean, and Chad A. Mirkin. Maximizing DNA Loading on a Range of Gold Nanoparticle Sizes. Anal Chem. 2006 Dec 15; 78(24): 8313–8318.
-
Feng Li,Hongquan Zhang,Brittany Dever,Xing-Fang Li,and X. Chris Le. Thermal Stability of DNA Functionalized Gold Nanoparticles. Bioconjug Chem. 2013 Nov 20; 24(11): 1790–1797.
.png)

