化学修饰是增强寡核苷酸药物递送的最有效方法之一。核酸骨架、核糖部分和碱基本身的修饰已被广泛采用以改善寡核苷酸药物的类药物特性,从而增强递送。具体来说,修饰用于改善寡核苷酸的药代动力学、药效学和生物分布。某些治疗方式(例如:gapmers)的功能也需要特定的修饰模式。化学修饰的重要性体现在:观察到广泛化学修饰的第二代gapmer ASOs 足以递送到各种组织,而无需额外的递送剂。此外,在迄今为止已批准的10 种的寡核苷酸疗法中(表1),有8 种是“裸”的(即缺乏额外的递送载体),因此仅依赖化学修饰来促进其组织递送。IonisPharmaceuticals 目前正在开发的gapmer ASO也是如此,包括用于治疗肌萎缩侧索硬化、阿尔茨海默病、中央核肌病,尤其是亨廷顿病的药物(表 2)。
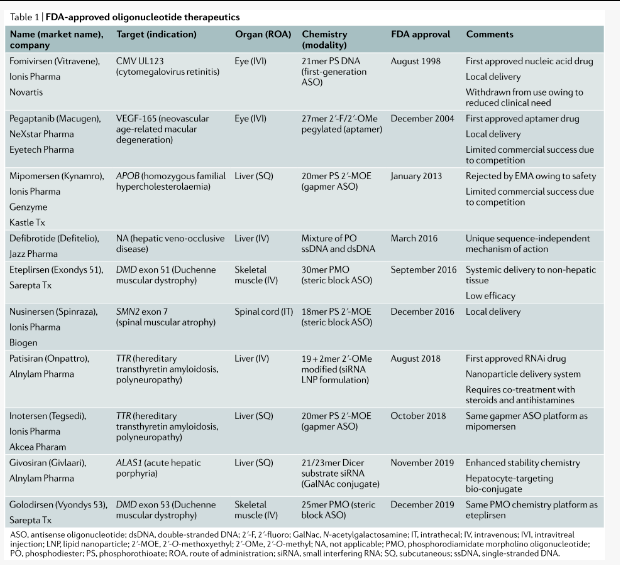
表1
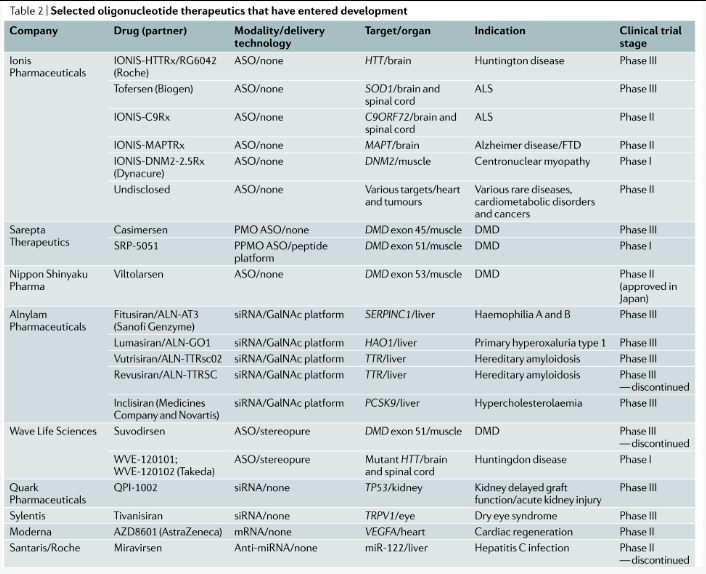
表2
寡核苷酸药物中常用的化学修饰包含以下几种:
骨架修饰
(Backbonemodification)
硫代磷酸酯(PS) 键的掺入(图1),其中核苷酸间磷酸基团的非桥连氧原子之一被硫取代,广泛用于治疗性寡核苷酸。还有许多其他种类的骨架修饰(例如:硼酸磷酸),尽管这些不太常用。PS 骨架修饰在ASO 设计中很容易被容许,并且不会破坏RNase H 的活性。相比之下,在每个连接处都含有PS修饰的siRNA 的活性低于等效的磷酸二酯(PO)siRNA,因此,如果siRNA需要修饰 PS的话通常仅在末端进行修饰。硫酸化分子,例如含有PS键或硫醇尾的寡核苷酸,也被由清道夫受体摄取(例如稳定素STAB1 和STAB2),介导它们内化到组织(例如肝脏)中。PS 键的掺入具有双重作用,即赋予核酸酶抗性和促进与血浆中和细胞内的蛋白质结合。寡核苷酸与血浆蛋白(如白蛋白)的相互作用通过增加循环时间(并因此降低肾清除率)来改善药物的药代动力学。然而,发现含有PS的gapmerASO 与血浆α2-巨球蛋白(A2M)的结合是非生产性的。寡核苷酸的 PS修饰还增加了与细胞内蛋白质(例如核仁素)的相互作用,相信这会促进它们在细胞核中的积累,是剪接转换寡核苷酸的靶位点。值得注意的是,对细胞核酸酶的抗性会导致组织保留时间延长和持久的药物作用。如果这是不符合需要的,例如,由于长时间的基因沉默而产生毒性的情况下,可通过降低寡核苷酸的核酸酶稳定性,将一个或多个PO键结合起来以“调节”寡核苷酸的耐久性。
PS骨架修饰的一个缺点是它们会降低寡核苷酸与其靶标的结合亲和力,这一限制可以通过加入其他类型的修饰来弥补。
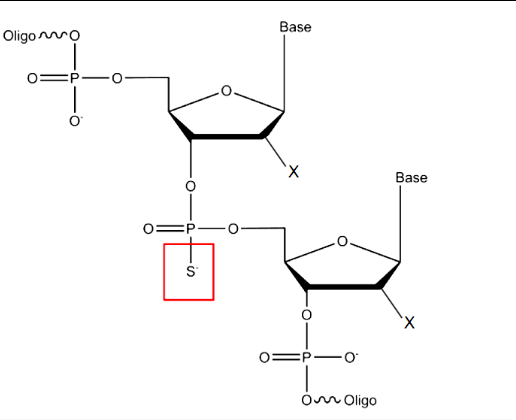
图1 硫代修饰示意图
注:X=H,DNA;X=OH, RNA
立体化学
(Stereochemistry)
在PS 键中引入额外的硫原子导致在每个修饰的磷原子处产生手性中心,具有两种可能的立体异构形式(分别指定为Sp 和Rp)(图2)。因此,一条全硫代(PS)修饰的PS的20mer寡核苷酸实际上是219种可能的排列的外消旋混合物(也就是说,超过50万个不同的分子)。每个立体中心的物理化学性质在疏水性/离子特性、核酸酶抗性、目标亲和力和RNase H 活性方面是不同的。特别是在gapmerASOs的“间隙”区域内包含的一个3ʹ-Sp Sp Rp-5ʹ的“立体化学代码”被发现特别活跃。WaveLife Sciences 开发了一种可扩展的方法来合成在每个PS 键上具有明确立体化学的寡核苷酸,并且正在推进具有明确立体化学的寡核苷酸药物,用于各种适应症。然而,由于在I 期临床试验中缺乏疗效,他们最近停止了suvodirsen 的开发,这是一种立体纯ASO,旨在通过跳过抗肌萎缩蛋白外显子51 来治疗杜氏肌营养不良症(DMD)。针对亨廷顿舞蹈病和C9ORF72 肌萎缩侧索硬化/额颞叶痴呆的立体纯寡核苷酸的平行临床项目正在进行中(表2Table 2)。
目前已获批或正在开发的寡核苷酸药物的外消旋混合物含有少量的高功能分子和许多表现出低活性的立体异构体,从而降低了大量混合物的整体效力。识别最活跃的立体异构体将为寡核苷酸药物的开发提供一个重要的进展,使更有效的化合物能够低剂量。值得注意的是,有人提出,需要立体随机混合物的Sp和Rp中心,以平衡稳定性和沉默活性。核苷酸立体化学也被用于适配体开发。
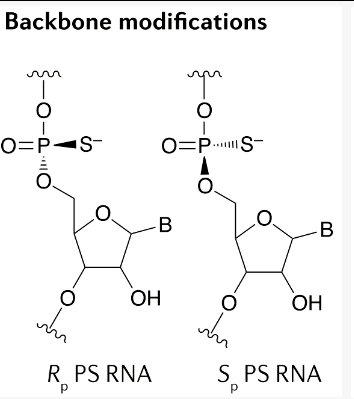
图2硫代两种立体异构体的结构
碱基修饰
(Nucleobasemodification)
碱基的化学修饰策略也研究中。例如,嘧啶甲基化(5 -甲基胞苷(5-methylcytidine)和5-甲基尿苷/核糖胸苷(5-methyluridine/ribothymidine))(图 3)具有提高寡核苷酸熔解温度的效果,每取代原来碱基增加约0.5 ° C,已被普遍整合进入ASO中(如Ionis制药公司正在研发的IonisPharmaceuticals)。此外,无碱基核苷酸(缺乏核碱基的核苷酸abasicnucleotides)(图 3)在维持靶基因切割活性的同时,取消miRNA样沉默,并对突变的HTT和ATXN3转录本进行等位基因特异性沉默。
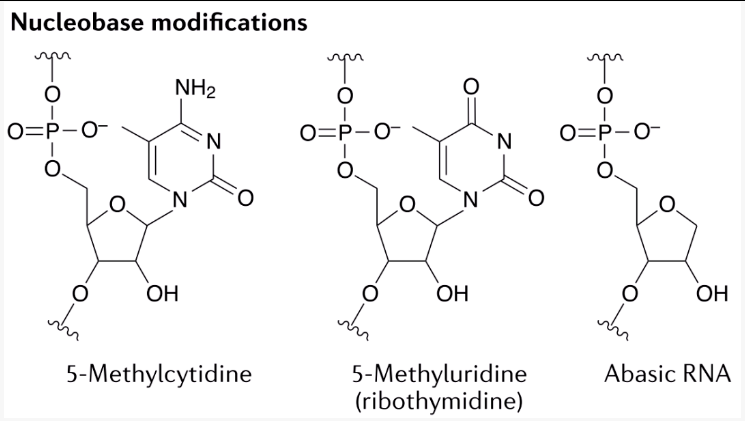
图 3
5-methylcytidine,5-methyluridine/ribothymidine和abasicnucleotides的结构式
末端修饰
(Terminalmodification)
siRNA 引导链5’ 末端的磷酸化对于活性至关重要,因为该基团在AGO2的 MID结构域中进行了重要接触。因此,通过细胞磷酸酶去除该末端磷酸基团具有降低siRNA 效力的作用。添加5’-(E)-乙烯基膦酸酯修饰物(图4)作为不是磷酸酶底物的磷酸盐模拟物。这种修饰还可以防止外切核酸酶降解和增强体内沉默。
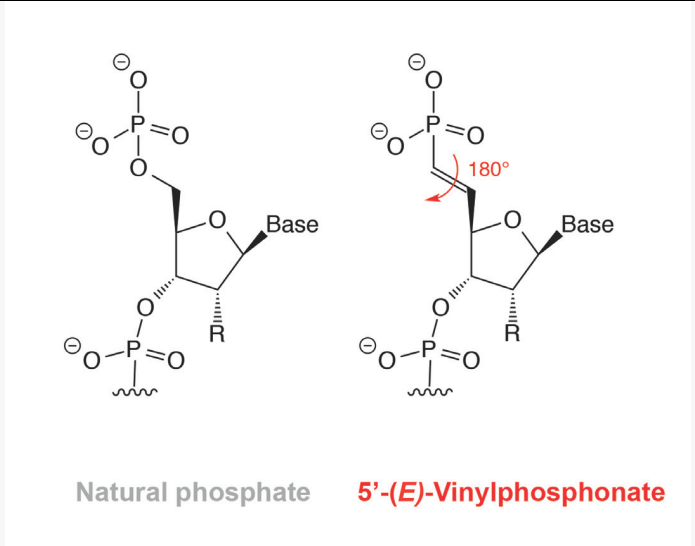
图4
注:5‘磷酸(5’P) 和5-(E)-乙烯基膦酸酯(5-VP) 的化学结构
核糖修饰
(Ribosesugar modification)
寡核苷酸经常在核糖的2ʹ 位被修饰。DNA(2ʹ-脱氧)和RNA 碱基的组合是影响gapmer ASO 活性的关键(即产生RNase H 底物异源双链体),并在一些siRNA 设计的3ʹ末端使用,以赋予核酸酶抗性。同样,2′-O-甲基(2′-OMe)、2′-O-甲氧基乙基(2′-MOE)和2′-氟(2′-F)(图5)是最常用的2′-取代基。这些修饰通过替换未修饰 RNA 的亲核2ʹ-羟基基团来增加寡核苷酸核酸酶的抗性,从而提高血浆中的稳定性,延长组织半衰期,从而延长药物作用。此外,这些修饰还通过促进核糖的3ʹ-内折叠构象(RNA样)来增强寡核苷酸对互补RNA 的结合亲和力。这些 2ʹ-核糖修饰与RNase H 活性不兼容,这意味着它们通常用于空间阻断寡核苷酸,或用于gapmer ASO 中的侧翼序列。
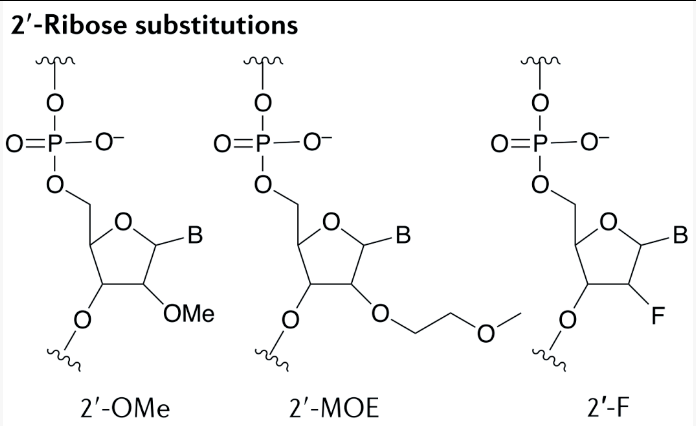
图5
2′-O-甲基(2′-OMe)、2′-O-甲氧基乙基(2′-MOE)和2′-氟(2′-F)结构式
桥接核酸
(Bridgednucleic acids)
桥接核酸(BNA) 是一类核苷酸,其中核糖的褶皱通过2' 和 4'碳原子之间的桥被限制在3'-内构象中。最常用的变体是锁核酸 (LNA) ,2′,4′-constrained2′-O-ethyl (cEt),2′‐O,4′‐C‐ethylene‐bridgednucleic acid (ENA)(图 6)。BNA 增强了核酸酶稳定性和寡核苷酸对目标RNA 的亲和力(在修饰LNA 的情况下,通常每个修饰核苷酸的解链温度增加3~8 °C)。BNA 修饰已被纳入gapmer的侧翼区域以改善目标结合。cEt 侧翼3-10-3 gapmers 比MOE 5-10-5 等效物更有效。相反,BNA 核苷酸与RNase H 介导的切割不兼容,因此被排除在DNA 间隙区域之外。LNA修饰也已用于空间阻滞ASO,例如miRNA 抑制剂。例如,miravirsen 和cobomarsen都是全硫代ASO 混合物,其中DNA和LNA修饰分布在序列之中。
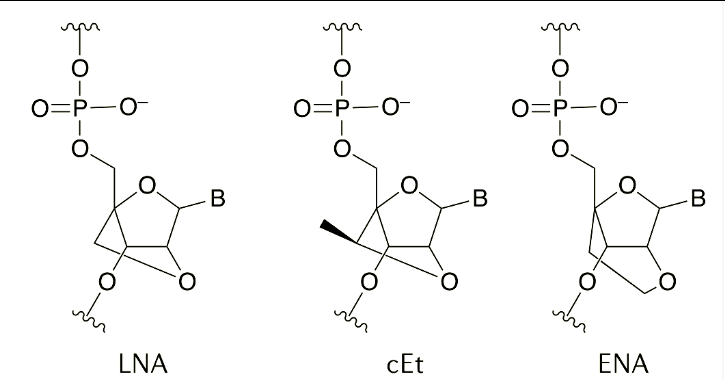
图6LNA,, cEt,,ENA结构图
注:cEt,constrained ethyl bridged nucleic acid; ENA, ethylene-bridged nucleicacid; LNA, locked nucleic acid
替代化学
(Alternativechemistries)
大多数寡核苷酸来自RNA或DNA,但已经开发出与这些自然原型有本质不同的其他化学物质。PMO(磷酸二酰胺吗啉寡核苷酸)电荷中性,其中五元核糖杂环被六元吗啉环取代(图6)。SareptaTherapeutics正在开发基于PMO的空间阻断ASO,用于DMD中的外显子跳跃(Table2表2)。迄今为止,FDA已经批准了两种PMO药物,eteplirsen和golodirsen(表1Table1)。PMO主干链包含手性中心,这意味着PMO药物必然是外消旋混合物。PMO尚未探索立体结构的影响。
另一种策略是使用肽核酸(PNA),一种核酸模拟物,其中假肽聚合物骨架替代DNA/RNA 的 PO骨架(图6)。由于 PMO 和PNA 都不带电,因此它们可以共价结合到带电的递送促进部分,例如细胞穿透肽(CPP)。这些化学物质的缺点是 PMO 和PNA 与血浆蛋白的相互作用最小,这意味着它们会通过尿排泄迅速清除。
还有一种是三环DNA(tricyclo-DNA简称tcDNA)(图7),每修饰一个能将RNA 靶标-寡核苷酸双链体的稳定性提高2.4 °C。
鉴于PMO、PNA和 tcDNA的非天然结构,这些化学物质不太适合RNase H 和 RNAi应用,而是用于空间阻滞寡核苷酸,特别是用于剪接校正。
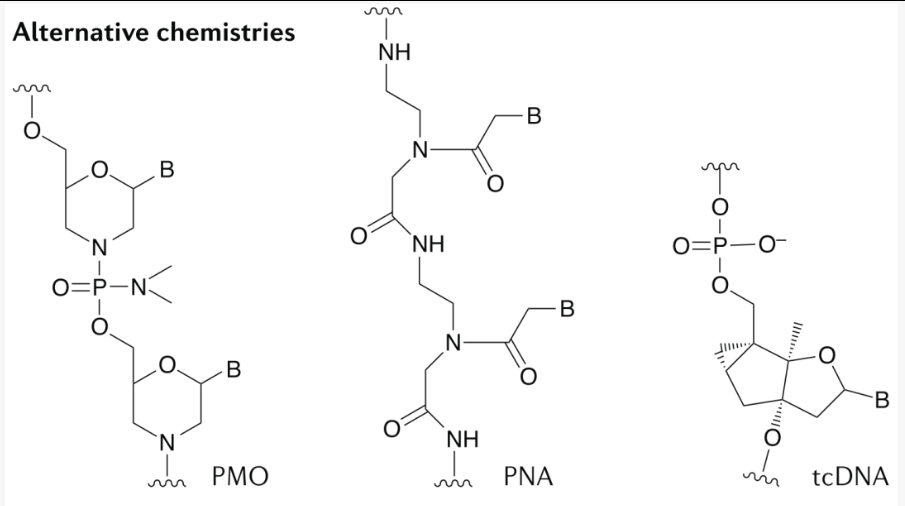
图7PMO, PNA 和tcDNA结构式
生工生物具有20多年寡苷酸合成的历史和经验,如有疑问,欢迎来电咨询生工技术人员,电话:400-821-0268。
参考文献:
[1] Roberts T C , Langer R , , Wood M . Advances in oligonucleotide drug delivery[J]. Nature Reviews Drug Discovery.
[2]Haraszti R A , Loic R , Coles A H , et al. 5΄-Vinylphosphonate improves tissue accumulation and efficacy of conjugated siRNAs in vivo[J]. Nucleic Acids Research, 2017(13):13.
图文来源于网络,侵权删
.png)

