转移是癌细胞扩散到远端部位的过程,造成约90%的癌症死亡率。它涉及高度协调的生物事件级联,由固有的癌细胞自主途径调节,以及癌细胞与各种肿瘤相关基质谱系(包括免疫细胞)的动态相互作用。据报道,转移起始肿瘤细胞显示出基本的内在特征,例如细胞可塑性、增强的迁移和侵袭能力、抗细胞凋亡和免疫编辑。此外,原发性肿瘤可以释放细胞因子、生长因子和其他蛋白质因子,这些因子能够为远处组织启动循环癌细胞的到来,从而创造一个能够支持转移性生长的转移前生态位。
癌细胞分泌的囊泡,尤其是外泌体,被认为是转移前生态位形成的重要介质。外泌体是大小为 30-150 nm 的内吞来源的小颗粒。肿瘤细胞分泌外泌体显着促进细胞间通讯和随后的肿瘤微环境重编程。除了外泌体核心蛋白(如 CD9、CD63、Flotillin-1、HSP70 和 TSG101)外,外泌体还含有多种其他蛋白质、核酸和脂质,具体取决于细胞来源。 癌细胞自主转移机制不仅涉及肿瘤细胞与远处器官微环境之间的直接受体/配体相互作用,还涉及癌症衍生的外泌体以器官特异性方式制备转移前生态位,即部分由外泌体的整合素组成决定。
肿瘤微环境是否以及如何调节癌症衍生的外泌体全身生物分布,从而影响它们的器官特异性定位和功能?需要更多的研究!
澳大利亚昆士兰大学的学者使用同系小鼠模型和癌症患者样本显示,肿瘤微环境细胞因子通过蛋白聚糖的糖胺聚糖 (GAG) 侧链与癌症衍生的外泌体结合。这些细胞因子结合的外泌体被特定组织中的细胞因子受体阳性细胞选择性吸收,导致这些次级器官的免疫景观以及外泌体生物分布发生变化,从而导致转移增加。

结
果
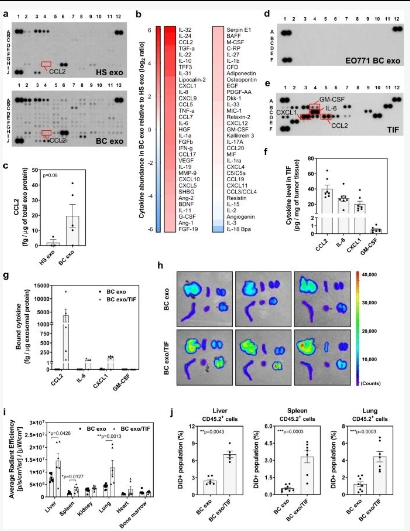
影响器官特异性外泌体积累并促进转移
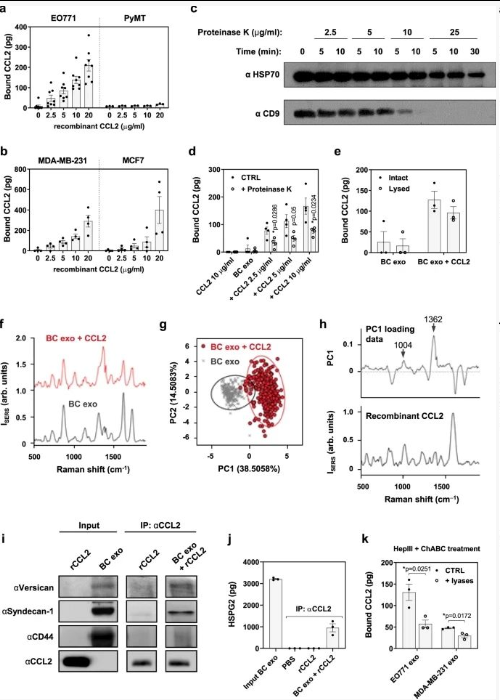
从健康受试者和乳腺癌 (BC) 患者血浆中分离的外泌体,确定了多种与外泌体共同分离的细胞因子和生长因子。
1、在 BC 上发现了更多的丰度和多样性患者来源的外泌体。来自 BC 患者的外泌体样品中更高水平的 CCL2 和 IL-6 增加。;
2、体外培养的 EO771 BC 细胞中分离的纯外泌体在很大程度上缺乏细胞因子和生长因子;
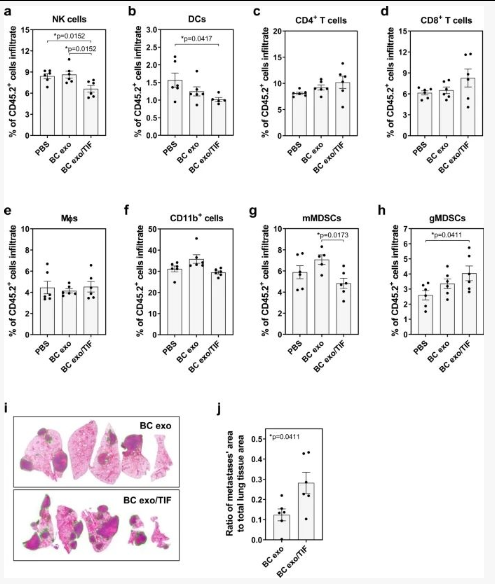
3、免疫细胞谱系,包括 NK 细胞 (CD3 − NK1.1 + )、巨噬细胞 (CD11b + F4/80 +) 和单核细胞和粒细胞髓源性抑制细胞 (mMDSCs, CD11b + Gr1 lo ; gMDSCs, CD11b + Gr1 hi ) 在肝脏、脾脏和肺中对 TIF 外泌体的外泌体摄取高于非结合外泌体;
4、重复注射 TIF 外泌体改变了肺、脾脏和肝脏的免疫细胞组成:双肺和脾脏NK 细胞减少;肺中 gMDSCs 的增加;肝脏中树突状细胞 (DC) 的频率降低;Ly6C -巨噬细胞增加。
结果提示:肿瘤微环境中的细胞因子能够与癌症衍生的外泌体相关联,从而诱导远端器官免疫景观的变化,从而增加转移负担。
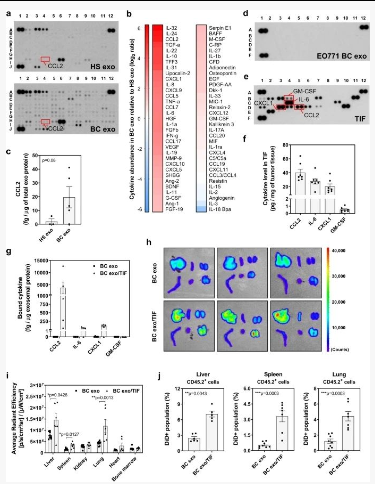
通过 GAG 侧链与外泌体结合
将重组人或小鼠CCL2和IL-6(两种细胞因子都存在于血浆外泌体分离物和TIF添加到两个人和两个鼠癌细胞系中衍生的外泌体。孵育后通过重新纯化外泌体去除未结合的细胞因子。
1、CCL2和IL-6 在这些环境中的外泌体分离物中;
2、蛋白酶 K 处理 CCL2 结合的 BC 外泌体,其浓度会导致外膜蛋白(如 CD9)降解,但不会降解囊内 HSP70,证实破坏仅限于外泌体表面;
3、大多数可检测的 CCL2 信号来自囊泡表面;
4、PC1 中导致 CCL2 外泌体分布的正峰表现出与 CCL2 信号相似;
5、添加肝素酶III(HepIII)和软骨素酶ABC(ChABC)裂解酶,分别催化蛋白聚糖的HS和CS链的降解,CCL2与外泌体的结合减少。
结果提示:外泌体样品之间的差异来自 CCL2 的 SERS信号诱导。
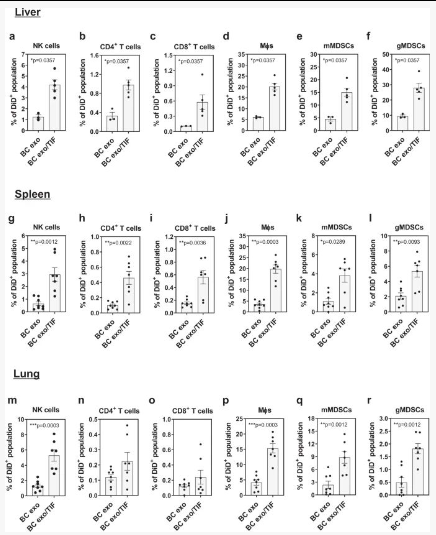
细胞因子结合改变外泌体生物分布和细胞谱系特异性摄取
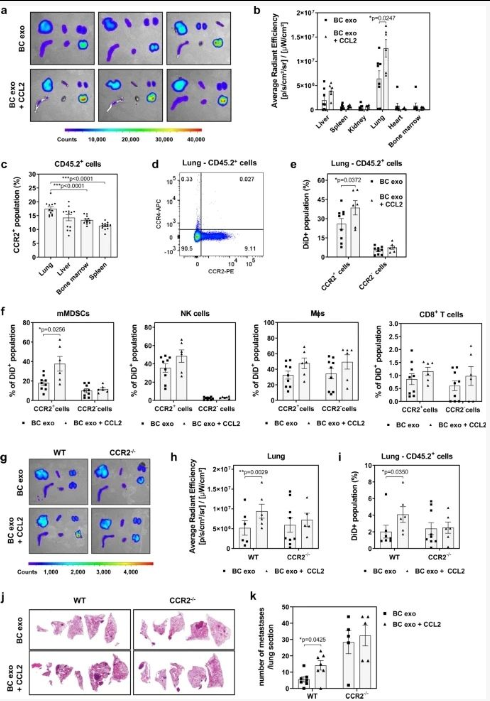
将 CCL2 缀合的荧光标记的 EO771 BC 细胞衍生的外泌体静脉注射到同系小鼠中。
1、各种器官(包括肝、脾、肾、肺、心脏和骨髓)的离体成像显示肺中 CCL2 缀合的外泌体积累显着增加;
2、CCR2 + NK 细胞特异性摄取 CCL2 缀合的外泌体增加的趋势,但无统计学意义;
3、CCL2 结合的 BC 外泌体对器官分布、肺积聚或肺 CD45没有影响CCR2 -/-小鼠中的CCR2 +细胞摄取;
4、用 CCL2 结合的外泌体对 WT 小鼠进行调理,然后注射同基因癌细胞,导致显著的(p < 0.05) 与非结合外泌体相比,肺转移形成增加,而在 CCR2 -/-小鼠的肺中未发现对 BC 转移的影响。
结果提示:外泌体结合的 CCL2 在 BC 转移传播中具有重要作用。
结论
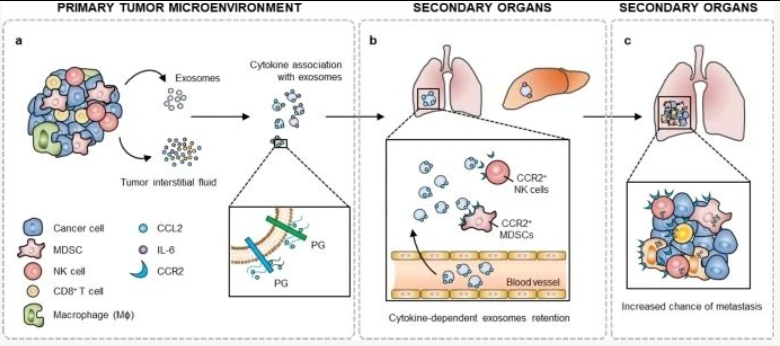
这些数据表明,CCL2 与 BC 外泌体的结合改变了它们的全身生物分布以及细胞谱系特异性囊泡摄取,并可能有助于 TIF 缀合的 BC 外泌体在远端器官中诱导的前转移变化,从而促进BC转移。
讨论
从功能的角度来看,细胞因子在外泌体和其他 EV 上的定位可能有助于其生物活性。由于细胞因子受体通常存在于细胞表面,与外泌体结合的细胞因子可以以配体/受体依赖性方式引导这些小囊泡靶向细胞。此外,这种细胞因子-外泌体结合可以特异性调节表达特定范围细胞因子受体的受体细胞,不仅通过囊泡的内容物摄取,还通过细胞因子/受体信号传导。
肿瘤微环境的组成已被证明会影响肿瘤生长早期阶段的癌细胞存活,从而决定抗癌治疗的成功,例如检查点抑制剂治疗。然而,目前大多数外泌体和基于 EV 的生物标志物方法都将这些囊泡的丰度作为指标。
研究表明:同时评估外泌体的整合素、蛋白多糖和细胞因子特征将更全面地提供关于假定转移位点的信息并确定成功的治疗策略。
LabEx,让服务加速实验!!!
LabEx可以提供包括包括组织水平、细胞水平、蛋白水平、分子水平的多种检测服务以及HALO分析服务。

液相悬浮芯片产品爆款
|
液相悬浮芯片技术经典十因子组合 |
||
|
品名 |
货号 |
指标 |
|
小鼠经典炎症十因子组合 |
LX-MultiDTM-10 |
IL-1beta/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/alpha/KC/CINC-1,IFN-gamma,TNF-alpha |
|
人经典炎症十因子组合 |
LX-MultiDTH-10 |
IL-1 beta/IL-1F2,IL-2,IL-4,IL-6 ,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,TNF-alpha,IFN-gamma |
| 种属(人) | |
|---|---|
| 货号 | 指标 |
| LX-MultiDTX-48 | FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| LX-MultiDTX-44 | CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CCL19/MIP-3 beta,CCL20/MIP-3 alpha,CD40 Ligand/TNFSF5,CXCL1/GRO alpha/KC/CINC-1,CXCL2/GRO beta/MIP-2/CINC-3,CXCL10/IP-10/CRG-2,EGF,FGF basic/FGF2/bFGF,Flt-3 Ligand/FLT3L,G-CSF,GM-CSF,Granzyme B,IFN-alpha 2/IFNA2,IFN-beta,IFN-gamma,IL-1 alpha/IL-1F1,IL-1 beta/IL-1F2,IL-1ra/IL-1F3,IL-2,IL-3,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-10,IL-12 p70,IL-13,IL-15,IL-17/IL-17A,IL-17E/IL-25,IL-33,PD-L1/B7-H1,PDGF-AA,PDGF-AB/BB,TGF-alpha,TNF-alpha,TRAIL/TNFSF10,VEGF |
| LX-MultiDTX-40 | 6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α/CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| LX-MultiDTH-27 | FGF basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12(p70), IL-13, IL-15, IL-17,IP-10,MCP-1(MCAF), MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF |
| 种属(小鼠) | |
|---|---|
| 货号 | 指标 |
| LX-MultiDTM-23 | IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
| LX-MultiDTM-31 | BCA-1/CXCL13, CTACK/CCL27, ENA-78/CXCL5, Eotaxin/CCL11,Eotaxin-2/CCL24,Fractalkine/CX3CL1, GM-CSF, I-309/CCL1, IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-10, IL-16, IP-10/CXCL10, I-TAC/CXCL11, KC/CXCL1, MCP-1/CCL2, MCP-3/CCL7, MCP-5/CCL12, MDC/CCL22, MIP-1α/CCL3, MIP-1β/CCL4, MIP-3α/CCL20, MIP-3β/CCL19, RANTES/CCL5, SCYB16/CXCL16, SDF-1α/CXCL12, TARC/CCL17, TNF-α |
| LX-MultiDTM-10 | IL-1beta/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,CXCL1/GRO/alpha/KC/CINC-1,IFN-gamma,TNF-alpha |
| LX-MultiDTMC-10 | IL-1beta/IL-1F2,IL-2,IL-4,IL-5,IL-6 ,IL-10,IL-12p70,KC,IFN-gamma,TNF-alpha |
| 种属(人) | |||||
|
TBNK |
TH1/TH2/TH17 |
MDSC |
DC |
Treg |
巨噬细胞 |
|
CD45 |
CD45 |
CD45 |
CD45 |
CD45 |
CD45 |
|
CD3 |
CD3 |
CD11B |
HLA-DR |
CD3 |
CD11B |
|
CD4 |
CD4 |
CD15 |
CD11C |
CD4 |
CD86 |
|
CD8 |
CD8 |
CD14 |
CD1c |
CD25 |
CD206 |
|
CD19 |
IFN-γ |
CD33 |
CD303 |
FOXP3 |
L/D |
|
CD56 |
IL-4 |
L/D |
L/D |
L/D |
|
|
L/D |
IL-17A |
||||
|
L/D |
|||||
| 种属(小鼠) | |||||
|
TBNK |
TH1/TH2/TH17 |
MDSC |
DC |
Treg |
巨噬细胞 |
|
CD45 |
CD45 |
CD45 |
CD45 |
CD45 |
CD45 |
|
CD3 |
CD3 |
LY6G |
MHC-II |
CD3 |
CD11B |
|
CD4 |
CD4 |
LY6C |
CD11C |
CD4 |
F4/80 |
|
CD8 |
CD8 |
CD11B |
CD80 |
CD25 |
CD86 |
|
CD45R |
IFN-γ |
GR-1 |
CD86 |
FOXP3 |
CD206 |
|
NK1.1 |
IL-4 |
L/D |
L/D |
L/D |
L/D |
|
L/D |
IL-17A |
||||
|
L/D |
|||||

扫码关注我们
查看更多精彩内容

