中和抗体是一种很有前景的抗SARS-CoV-2感染的治疗方法。它们大多数靶向SARS-CoV-2刺突(S)糖蛋白的受体结合域(RBD),通过阻断病毒与宿主细胞的结合来控制感染。然而,随着新冠病毒的不断变异,其传播速度和逃逸突变能力大大增加。在这篇文章中,为了防止突变病毒逃逸,作者开发了一种基于B38和H4的双特异性单克隆抗体bsAb15,经过验证它可以有效中和逃逸突变体。

1
bsAbs的设计与表征
为了获得功能性bsAb,作者利用两种人单克隆抗体B38和H4为亲本单克隆抗体设计了4个bsAb。其中bsAb13和bsAb14是双变量结构域免疫球蛋白(DVD-Ig),bsAb15和bsAb16是IgG-ScFv格式。为了测试这些bsAb上的两个可变区域是否相互干扰,并可以靶向RBD抗原,作者使用生物分子层干涉法进行了竞争分析,将生物素化SARS-CoV-2 RBD 固定在链霉亲和素传感器上,用B38或H4饱和,然后用bsAb饱和。
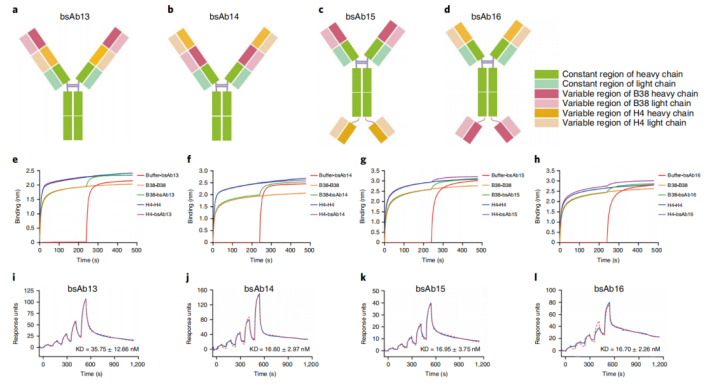
图1. bsAbs的设计与表征
结果表明bsAb15和bsAb16上的RBD结合位点都可以呈现出来,而bsAb13和bsAb14的B38与H4表位不能同时结合RBD蛋白。此外,作者通过表面等离子体共振(SPR)的亲和性分析发现,与B38或H4相比,这些bsAbs对RBD表现出相似的亲和性(图1)。
2
bsAbs的中和特性
作者用SARS-CoV-2假病毒和真病毒进行了中和试验。假病毒中和:利用复制缺陷性水疱性口炎病毒载体骨干(VSV-∆G-GFP)质粒和相应的缺失残基的S质粒共转染HEK293T细胞生成假病毒。抗体稀释液与假病毒混合孵育培养。采用CQ1定量共聚焦图像细胞仪进行观察细胞病变效应(CPE)并计算IC50值。真病毒中和:将抗体稀释后与病毒混合孵育培养,观察CPE计算IC50值。
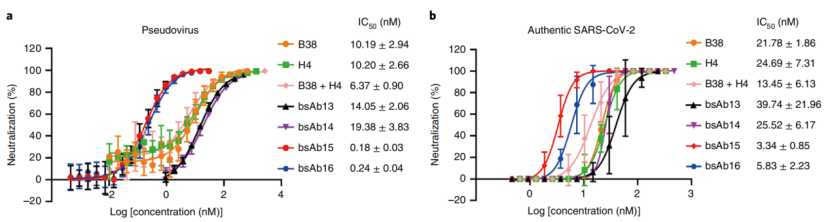
图2.假病毒和真病毒抗体的中和效果
结果表明bsAb15和bsAb16对SARS-CoV-2假病毒的中和能力相当,明显低于抗体鸡尾酒疗法(即使用两种与S蛋白不同表位结合的人抗体)或亲本单抗。bsAb13和bsAb14对假病毒的中和能力与B38或H4相似。在SARS-CoV-2真病毒感染系统中,bsAbs表现出相似的中和趋势(图2b)。与B38或H4相比,bsAb13对真病毒的中和作用相对较弱。此外bsAb14与B38或H4具有相似的中和能力,并且通过评估bsAb15的抗体依赖增强(ADE)效应发现bsAb15不会引发抗体依赖病毒进入。
3
bsAb15在体内预防SARS-CoV-2感染效果
由于bsAb15在SARS-CoV-2假病毒和真病毒感染中表现出最强的效力,因此作者在动物模型中评估了它体内保护功效。作者在复制缺陷腺病毒(Ad5-hACE2)小鼠模型中进行了预防和治疗实验(图3a)。在小鼠感染SARS-CoV-2病毒的前后不同的时间注射bsAb15作为预防组和治疗组,感染后3天后处死所有小鼠,然后用RT-qPCR法测定每克组织的RNA拷贝量,确定各组小鼠肺部病毒载量,并采集肺切片制备H&E染色玻片。
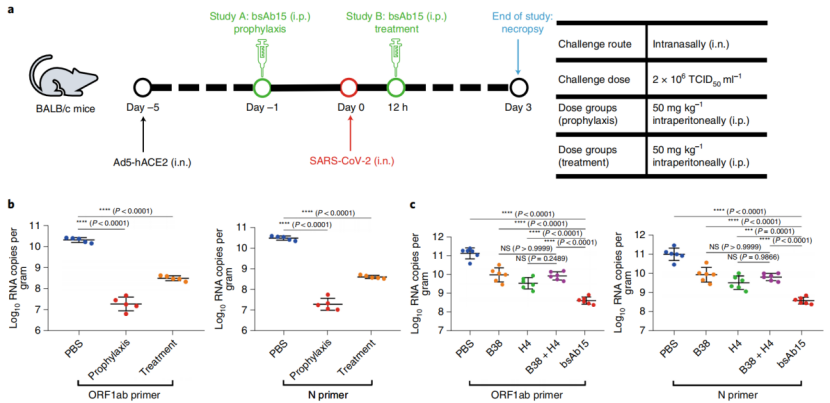
图3. bsAb15对SARS-CoV-2感染小鼠模型的治疗和预防作用
结果发现与PBS对照组相比,预防组和保护组肺内病毒滴度均显著降低(图3b)。为了比较bsAb15、抗体鸡尾酒疗法和亲本单抗的效率,在SARS-CoV-2病毒感染12 h后,每组小鼠分别注射抗体(B38、H4、B38和H4的组合或bsAb15)发现,bsAb15治疗组的病毒RNA水平明显低于鸡尾酒组和亲本单抗治疗组(图3c)。
对感染小鼠的肺部进行了病理分析表明,对照组小鼠肺组织显示中度间质性肺炎,预防组未观察到实质性的病理变化,而治疗组小鼠表现出轻度间质性肺炎。与病理定量分析软件估计PBS对照组、预防组和治疗组肺部炎症面积百分比分别为40.67%、12.61%和26.54%的趋势相同。
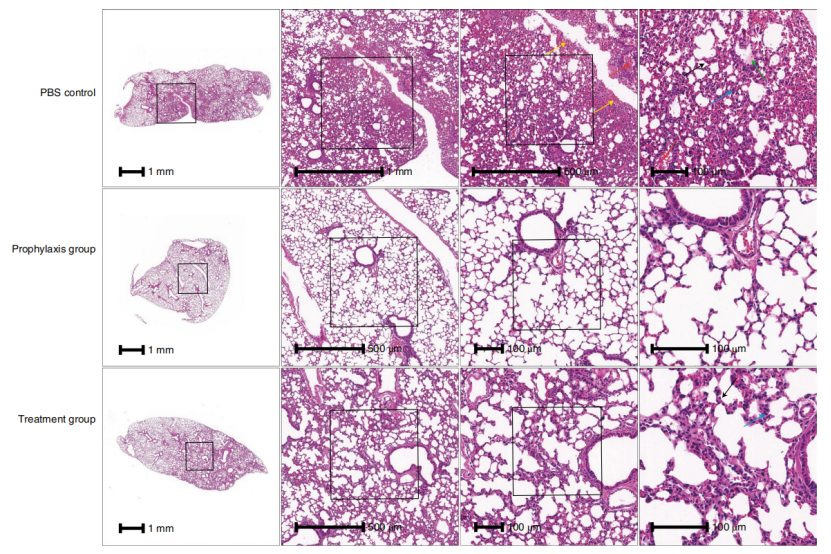
图4. 感染小鼠的肺的病理分析。
作者为了评估预防和治疗组对恒河猴SARS-CoV-2感染模型的保护效果(图5),将恒河猴设置为对照组、预防组、低剂量治疗组和高剂量治疗组,注入病毒后,每天采集咽拭子和鼻拭子样本,通过qPCR检测病毒载量。结果显示治疗组的动物在咽喉和鼻腔拭子中显示出较低的病毒载量,且高剂量和低剂量单抗在本研究中的疗效相似。
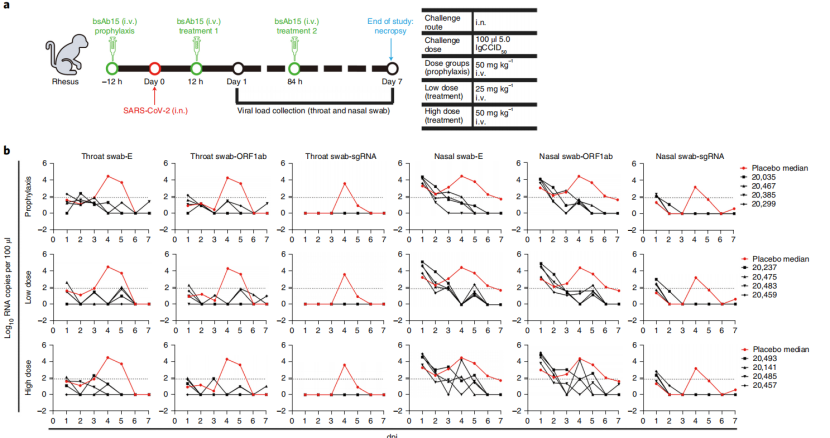
图5. bsAb15对恒河猴的防治效果
4
逃逸突变体筛选
作者使用SARS-CoV-2病毒在单抗体、抗体组合和bsAb压力下筛选逃逸突变体(图6a)。将抗体稀释后加入单层Vero E6细胞中进行孵育培养,并监测CPE。然后在相同抗体压力下进行传代培养。从第1代和第3代细胞中分离病毒RNA,进行cDNA合成和文库制备并进行测序。
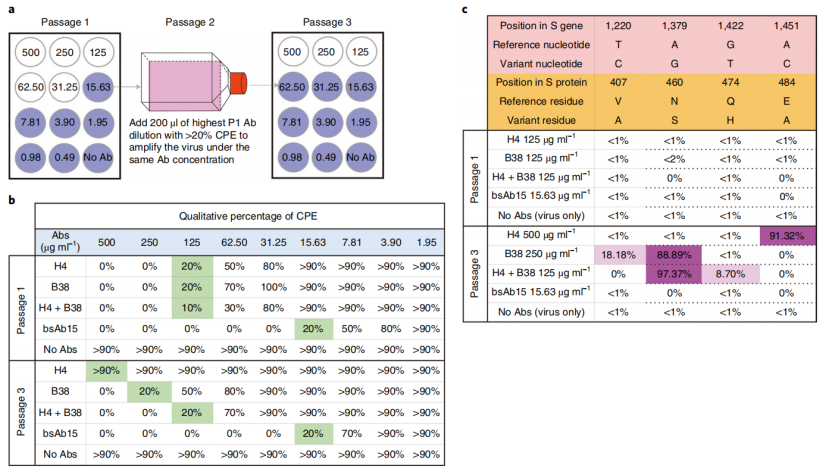
图6.逃逸突变体筛选
结果显示在H4存在的情况下,逃逸突变体E484A在第三代就容易在群体中固定,且对高剂量H4具有抗性。对于B38,第三代后逃逸突变体N460S和V407A占优势。在B38和H4组合的压力下,三次传代后细胞病变效应(CPE)的最高抗体浓度相同。相比之下,bsAb15组在第一代和第三代中显示出相似的CPE质量百分比(图6b),并且在RBD区域未观察到显性逃逸突变体(图6c),这表明与单抗体治疗或抗体鸡尾酒疗法相比,bsAb可能导致更小的选择压力。
5
bsAb15的生化和体外中和特性
作者为了验证哪些突变体可能导致抗体活性的丧失,表达了突变的RBD蛋白,并通过SPR检测RBD突变体与抗体的亲和力(图7a)。分析发现S蛋白的K417N突变导致RBD突变体无法与B38结合,N460S突变使RBD突变体与B38的结合减少,E484K和E484A突变使RBD突变体无法与H4结合,而bsAb15对这些RBD突变体仍具有亲和性。N501Y突变不影响RBD与抗体的相互作用。此外,与野生型(WT) RBD相比,B38和bsAb15与突变体的结合亲和力显著提升,但bsAb15无法与包含K417N、E484K和N501Y突变的Beta变体的RBD的结合。另外在这些突变残基中,K417N和E484K可能是导致亲和性丧失的关键残基。
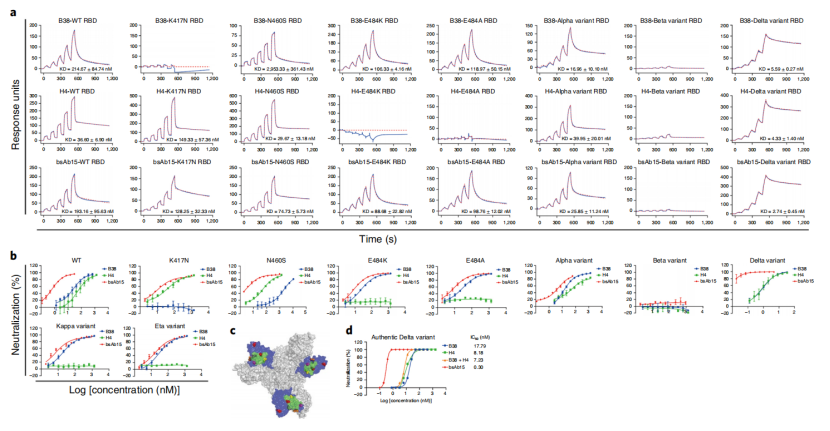
图7. bsAb15对突变假病毒的亲和性及其中和能力。c:不同变体中突变的RBD残基在S蛋白三聚体结构上分别为红色(K417和N501)、黄色(N460)、橙色(E484)和品红(L452和T478)球体。表面表示为B38的RBD(蓝色)和表位(绿色)。
作者利用SARS-CoV-2假病毒进一步评估了bsAb15的体外中和能力。结合实验结果显示,除了Beta变体外,bsAb15对携带逃逸突变的假病毒仍然有效,且对Delta假病毒具有较强的中和作用。结构分析支持中和和结合结果(图7c),K417和N460位于B38表位上,而E484位于B38表位边缘,N501位于B38表位之外。
综上所述,bsAb15在抗病毒活性、抑制逃逸突变的能力以及规避抗体依赖性增强效应等方面均有较好的表现。除Beta变体外,bsAb15对突变假病毒表现出比亲本单克隆抗体更高的疗效。因此,这种bsAb是治疗和预防重症COVID-19的可行而有效的策略。bsAbs对SARS-CoV-2病毒感染具有强大的中和作用和保护作用,并且在体外实验中,病毒在单一抗体的压力下比bsAb更容易逃脱。另外在药物开发中,bsAb比使用单一或抗体鸡尾酒疗法更具成本效益,可以满足因COVID -19相关疫苗和治疗方法而增加的生产能力需求。
参考文献:
Li, Z., Li, S., Zhang, G. et al. An engineered bispecific human monoclonal antibody against SARS-CoV-2. Nat Immunol 23, 423–430 (2022).
来源于优宁维药物研发官网

