1
背景介绍
抗体-药物偶联物(ADC)是一种有效的癌症靶向化疗治疗药物,它是通过特异性靶向肿瘤细胞肿瘤相关抗原(TAAs)的单克隆抗体(mAb)与高效细胞毒药物结合而产生的。为了更高效的设计ADC分子,分析表征方法显得尤为重要。提高分析表征的速度和效率,找到可靠、可重复、自动化的分析方法是分析ADC及抗体药物结构的迫切需求。

在这里,文章以T-DXd(Trastuzumab deruxtecan,曲妥珠单抗deruxtecan )为研究对象,在完整水平和中等水平分别采用常规反相LC (rpLC),尺寸排除色谱(SEC)、阳离子交换色谱(CEX)和疏水相互作用色谱(HIC)与原生质谱法(nMS)的耦合的多种方法对T-DXd进行了表征。
T-DXd由人源化单克隆抗HER2曲妥珠单抗抗体、可切割的肽基稳定血浆连接子(GGFG)和强效拓扑异构酶I抑制剂有效载荷(DXd)组成,用于不可切除或转移性HER2阳性乳腺癌患者的三线治疗。
2
实验结果
(1)
T-DXd的rpLC-MS分析
作者利用rpLC-MS方法在完整抗体水平进行检测,观察到色谱图中有两个种类:(i)偶联一种药物的轻链,(ii)偶联三种药物的重链(图1A)。此外,在轻链中观察到脱酰胺,重链检测到氧化修饰作为其中一个小的种类。平均药物偶联抗体比率(avDAR)为8.0。
为了明确药物偶联的定位,作者在变性条件下对T-DXd进行了中上水平亚基分析。使用IdeS酶(Genovis, Lund, Sweden)在铰链区下方特异性地对单抗进行酶切使其成为更小的亚基。酶切后质谱图显示T-DXd轻链包含三个主要的峰,其中轻链连接一个药物,Fd亚基连接3个药物,Fc/2区域未偶联药物(图1B)。获得的离子色谱图(avDAR = 8.0)中,没有检测到未与DXd结合的轻链或Fd的信号,与完整水平的分析结果一致。此外还观察到一种含有氧化修饰的较小的种类。
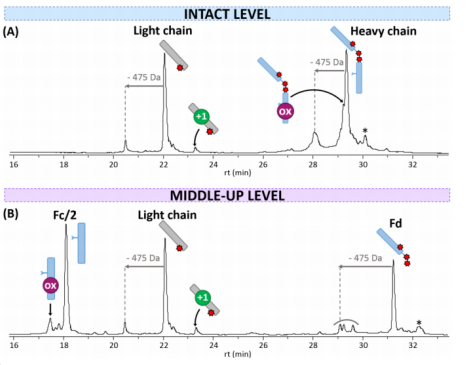
图1:IdeS消化后的色谱图(A)为完整抗体,(B)为中上水平分析。彩色形状表示不同PTMs对应的修饰:氧化(OX,紫色)和脱酰胺(+1,绿色)。药物用红星表示。
为了进一步了解T-DXd及其曲妥珠单抗的大小、疏水性和电荷变体等特征,作者在完整水平和中等水平了采用SEC、CEX和HIC与nMS的耦合的方法对T-DXd进行表征。
(2)
SEC-nMS用于尺寸变量分析
聚合体(高分子量种类,HMWS)和片段(低分子量种类,LMWS)是ADC药物必须表征的关键质量属性,通常使用SEC-UV进行分析。该研究结果显示,单体主糖基G0F/G0F测得质量为156,339±1 Da,与含有8个偶联药物的单抗一致(G0F/G0F预计质量为156,339 Da)。在较短的保留时间中检测到少量的HMWS,在较大的洗脱体积中未检测到显著量的LMWS。
中上水平亚基分析可以更精确地了解药物在单抗不同部位(Fab和Fc)上的定位,本研究用IdeS酶(Genovis, Lund, Sweden)对单抗消化后进行中上水平分析实验后发现,Fc亚基上没有任何药物附着(主要糖型G0F/G0F为50463.9±0.4 Da,图2D),与之前所有的LC-MS数据一致。如预期的一样,每个Fab片段包含4个有效载荷(峰值2,52,954.4±0.5 Da,图2E)。
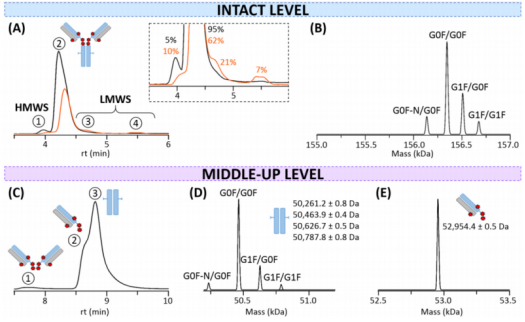
图2. (A)完整抗体(黑色)和强制降解-高温处理(橙色)T-DXd的SEC-UV色谱图。(B)完整单体(峰2)的质量反褶积。(C) IdeS酶切后的T-DXd的SEC-UV色谱图。(D) Fc亚基的质量反褶积。(E) Fab区的质量反褶积。
(3)
HICxSEC-nMS用于药物偶联评估
作者用HICxSEC-nMS对药物进行药物偶联评估,结果显示T-DXd的两个主要种类在完整水平上被部分分离(图3A)。大约在36.2分钟时的峰值对应于含有8种药物的单体,与SEC-nMS检测到的主要DAR8种类一致。亲水性较强的变体H1由于与主要形式的共洗脱而不能清晰地进行质量鉴定。
在IdeS酶(Genovis, Lund, Sweden)消化后,T-DXd的HIC剖面与完整水平相比更加清晰,因为两个亚基都发现了几个变体。Fc亚基分离出两个种类:主要的未修饰种类和具有一次氧化的亲水变体(H1)(图3B),与已经报道的rpLC-MS结果一致。Fab亚单元包括一个主要的未修饰种类,含有4个完整的药物和一个亲水变体H'1,含有一个氧化修饰。既没有检测到含有较少药物数量的种类,也没有检测到游离的未偶联Fab形式。
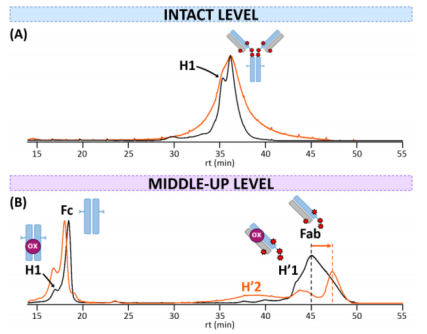
图3. 参比(黑色)和强制降解-高温处理(橙色)T-DXd的HIC-UV色谱图(A)为完整水平,(B)为中上水平。彩色形状表示对应于每种电荷变体的修饰:氧化(氧化,粉红色)。
(4)
CEX-nMS用于电荷变体分析
在完整曲妥珠单抗上进行的实验表明存在三种不同的种类:(i)一种主要的未修饰种类,(ii)一种对应于脱酰胺作用的酸性变体,(iii)一种被鉴定为isoAsp的基本变体。由于T-DXd的疏水药物与固定相的相互作用,影响了CEX分离的质量。由于色谱分离分辨率低可能无法识别其他存在的PTMs(翻译后修饰)。
T-DXd使用IdeS酶(Genovis, Lund, Sweden)消化后在中上亚基水平的分析比完整水平分析更具优势,因为它可以提供电荷大小变量的定位以及更精确的质量测量,以简化PTMs识别。在Fc亚基中观察到5种不同的基本变体(图4B)。Fab亚基有两个酸性变体。还观察到一种碱性种类(B'1)。除了PTMs外,所有Fab变体都含有4种药物。通过实验表明中上水平的CEX-nMS分析无需大量事先样品制备的情况下快速识别PTMs的适用性。
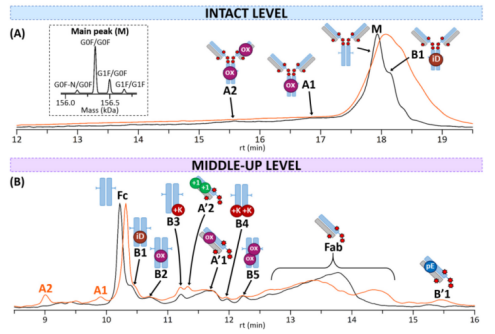
图4. 参比(黑色)和强制降解-高温处理(橙色)T-DXd的CEX-UV色谱图(A)在完整水平(主峰M的MS反褶积),或(B)在中上水平。酸性变体用字母A表示,碱性变体用字母b表示。单抗卡通用彩色圆点表示每种电荷变体对应的不同修饰:氧化(ox,粉红色),isoAsp (iD,棕色),c端Lys (+K,红色),pyroGlu (pE,蓝色),脱酰胺(+1,绿色)。
3
结论
本文章以T-DXd为例,说明了生物制药的表征具有挑战性,需要结合多种分析策略,以全面了解单克隆抗体或ADC的微观异质性。SEC、HIC和CEX三种技术分别从蛋白质异构体的大小、疏水和电荷变体对药物进行了表征。表格总结了这些技术的优点和局限性。
来源于优宁维药物研发官网

