糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(GITR)在调节T细胞的效应功能中发挥关键作用。然而,在临床试验中GITR激动剂抗体治疗效果有限,或许与介导的信号传导不佳有关。为突破限制,作者设计了PD-1-GITR-L双抗作为GITR激动剂用于癌症免疫治疗。我们来一起学习nature cancer的这篇《An anti-PD-1–GITR-L bispecific agonist induces GITR clustering-mediated T cell activation for cancer immunotherapy》。

PD-1-GITR-L双抗诱导PD-1依赖和FcγR不依赖的GITR聚集,从而增强启动抗原特异性GITR+PD-1+ T细胞的激活、增殖和记忆分化。是一种PD-1导向的GITR-L结构,在同基因、基因工程和异种移植人源化小鼠肿瘤模型中显示了剂量依赖的、免疫驱动的肿瘤生长抑制,靶饱和与记忆T细胞Ki67和TIGIT上调之间存在剂量依赖性。
为比较不同GITR受体聚集水平相对应的T细胞共刺激信号,作者设计了不同的结构。基于GITR-1和抗GITR的结构表现出最佳的寡聚和生物活性。十二价的GITR-L六聚体Fc结构可观察到T细胞活性显著增加,IL-2和IFN-γ分泌增加。十二价抗GITR-L六聚体比抗GITR抗体表现出更高的活性,这表明GITR信号可以独立于FcγR而诱导。基于这一机制,作者设计了抗PD-1–GITR-L双特异性抗体,其中抗PD-L1增强GITR聚集和NFκB信号。抗PD-1/GITR-L双抗在NFκB-GITR+Jurkat细胞中诱导了更高水平的NF-κB信号。将10万个细胞接种在96孔的平底板中,并对抗体进行连续稀释。24小时后,使用BriteLitePlus(6066761,PerkinElmer)定量荧光素酶活性。Jurkat-NFκB-GITR+稳定细胞。对转导的细胞进行分类,筛选人GITR和NFκB的表达,然后与抗CD3孵育48h,诱导PD-1表达上调。
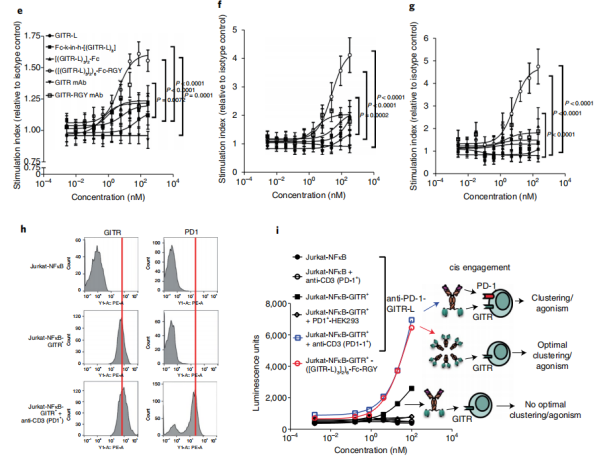

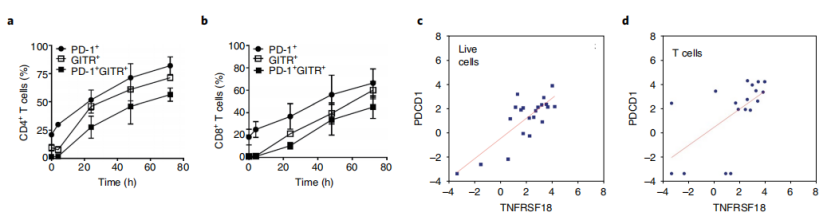
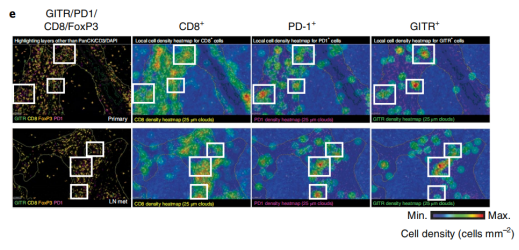
随后,作者通过流式细胞术证实,TCR激活的T细胞上,PD-1和GITR共表达。根据信使RNA测序(mRNA-seq)分析和免疫组化(IHC),在不同的癌症适应症中,肿瘤浸润淋巴细胞中也发现了较高的PD-1和GITR表达水平。
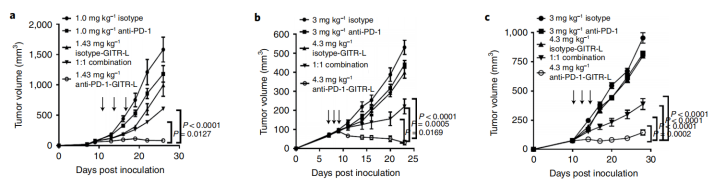
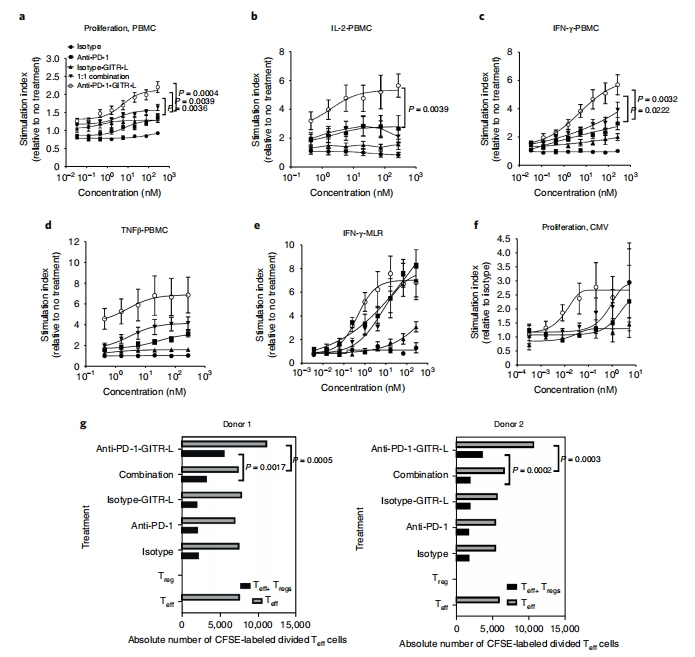
随后,作者在小鼠模型中及在体外人类PBMC刺激试验中测试抗PD-1/GITR-L双抗的抗肿瘤效果。抗PD-1-GITR-L双特异性与单药和同期组合的效果相比,具有不同的MoA。比较了与抗PD-1和GITR-L的单药以及1:1联合用药。结果显示,相比于单药和联合给药,抗PD-1/GITR-L双抗显示出最佳的抗肿瘤效果。
在人外周血单核细胞共刺激试验中,与单药和1:1联合给药相比,抗PD-1/GITR-L导致PBMC剂量依赖性增殖、IFN-γ、IL-2和TNF-β增强。PBMCs,2×105细胞/孔,96孔U底板,含有0.5µgml-1抗人CD3。48h和96h后,收集上清液,使用AlphaLISA技术分析IFN-γ和IL-2(PerkinElmer)。对于自体MLR,树突状细胞(DCs)通过培养1×108粘附的PBMCs与4.8µg GM-CSF,3µg IL-4(7天)和12ngIL-1α和TNF-α(5天)获得。第7天,收集树突状细胞,在414Rmin-1条件下照射7.3 min。将辐照后的树突状细胞(104个/孔)和纯化的CD4+Tcells(105个/孔)添加到96孔的U型底板中。5天后,收集上清液,使用AlphaLISA技术分析IFN-γ(PerkinElmer)。证实:双特异性诱导了自体CD4+ Tcell混合淋巴细胞反应(MLR)中IFN-γ的产生和人巨细胞病毒(CMVpp65)中的Tcell增殖。单药和联合给药相比,抗PD-1/GITR-L导致Teff(CD4+CD25-)细胞增殖的百分比更高。此外,由于最佳的GITR交联,仅在抗PD-1/GITR-L的双抗组中观察到在没有Treg细胞的情况下Teff细胞的增殖。
最后研究了食蟹猴抗huPD-1-huGITR-L的交叉反应性。抗huPD-1-huGITR-L与细胞表面食蟹动物PD-1和GITR转染的细胞,与活化的细胞PBMCs和重组蛋白抗原结合,用抗huPD-1-huGITR-L处理食蟹猴PBMCs,可诱导HEK293 cynoGITR+报告细胞系的增殖和NFκB信号通路。所得结论支持利用食蟹猴作为鉴定抗huPD-1-huGITR-L PD生物标志物的相关物种。
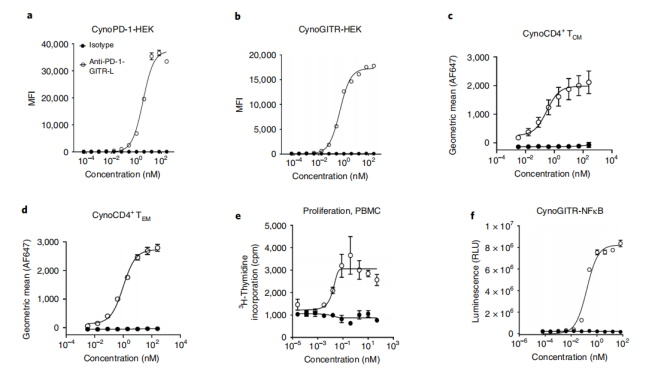
该双抗即独立于FcγR结合诱导最佳TNFR聚类的双特异性激动剂比单克隆抗体和TNFR配体更有效,且支持在小鼠中观察到的生物学转化为NHP和人源化系统的结论。如此看来,抗huPD-1-huGITR-L双特异性是一种前景极大的免疫治疗方法,通过优化聚类介导的抗原特异性T cells共刺激来克服PD-(L)1难治性患者的免疫逃逸。
来源于优宁维药物研发官网

