糖基化会影响生物药物的安全性、有效性和生物利用度。因此,为了研究聚糖结构,糖工程引起了人们的密切关注。利用酶进行聚糖重构为构建具有高效率和高生物相容性的聚糖提供了一种潜在的策略。在这项研究中,作者受固相多肽合成(SPPS)的启发,开发了一种solid-phase glycan remodeling (SPGR) 的平台,评估了多种用于糖工程的酶,并在固相平台中进行连续的聚糖重塑,使IgG聚糖形成一系列复杂的具有高产量和高效率的N-糖糖型,同时保持天然的IgG结合亲和力。
1
用于IgG糖工程的SPGR的设计
作者为了实现高效、连续聚糖重塑,将IgG固定在protein A树脂上,然后进行酶反应。SPGR工艺包括5个步骤:①装载树脂;②固定IgG;③洗涤;④酶促聚糖重塑;⑤IgG洗脱。为了表征IgG的糖型,作者使用PNGase F分离IgG聚糖,然后进行荧光团标记、固相萃取(SPE)纯化,然后进行LC-MS分析(图1a)。作者分析鉴定了34种用于SPGR的糖工程酶的活性,包括外糖苷酶、内糖苷酶和糖基转移酶(图1b)。
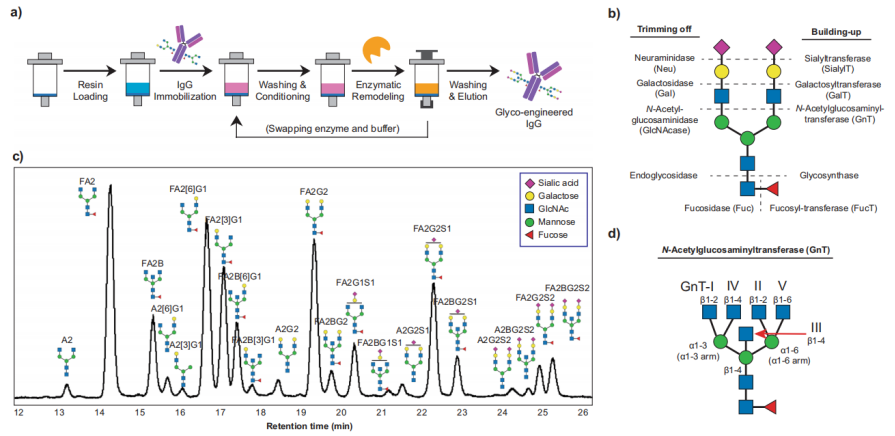
图1
2
用糖苷酶表征IgG聚糖
在IgG的Fc端天冬酰胺297位点处有两个高度保守的糖基化位点,有超过20种的复合型糖型,其中大多数在双天线结构中(图1c)。大约20%的IgG聚糖含有通过α2-6键连接的末端唾液酸。约70%的IgG聚糖含有末端β1-4半乳糖。N-乙酰葡糖胺(GlcNAc)存在于所有N-聚糖中(图1d)。
为了表征IgG糖型,作者首先利用神经氨酸酶(Neu,或唾液酸酶)去除末端唾液酸,半乳糖苷酶(Gal)去除半乳糖,N-乙酰氨基葡糖苷酶(GlcNAcase)去除GlcNAc,使其成为(F)M3型结构(图3a)。为了鉴定能够在天然条件下从完整IgG中去除岩藻糖的酶,作者测试了七种岩藻糖苷酶,都没有表现出较好的活性。作者又用(F)M3聚糖结构的IgG测试了岩藻糖苷酶,发现来自Candidatus omnitrophica的酶在此底物上显示出较好的活性。
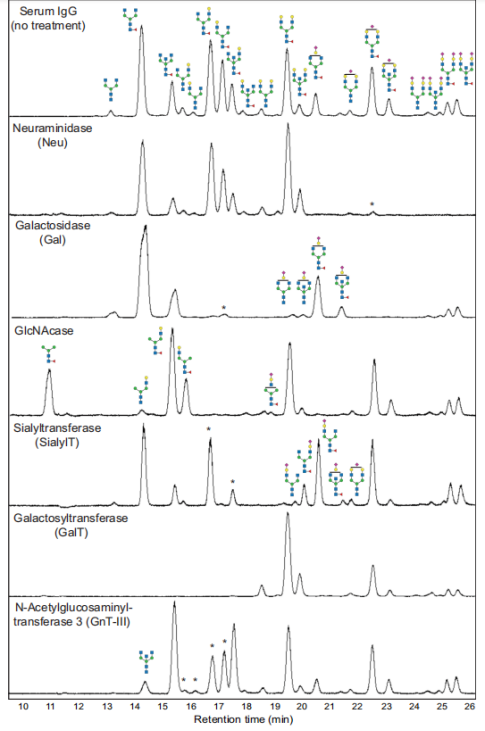
图2
3
用糖基转移酶构建IgG聚糖
作者通过试验筛选出活性最高的唾液酸转移酶(SialylT),它通过α2-6键将唾液酸转移至含有半乳糖末端的IgG上(图2)。在该酶的作用下,二半乳糖聚糖(FA2G2)和在α1-3键具有半乳糖的单半乳糖聚糖(FA2[3]G1)完全转化;而α1-6键(FA2[6]G1)的单半乳糖聚糖仅显示出最小的唾液酸化。接着,作者用半乳糖转移酶(GalT)催化半乳糖从尿苷5'-二磷酸半乳糖(UDP-Gal)转移到具有末端GlcNAc的IgG聚糖上。它能够将所有非半乳糖化和单半乳化的IgG聚糖转化为双半乳糖化形式。
然后作者又验证了五种N-乙酰葡萄糖转移酶(GnT)的活性,发现GnT-I、III和V均有活性。且使用血清IgG作为底物的反应表明,GnT III可以在至少含有一个末端GlcNAc的IgG糖型上发挥作用(图2)。最后,作者使用α1,6-岩藻糖转移酶(FucT)催化岩藻糖残基转移到末端GlcNAc残基上。并且作者发现FucT对完整的IgG具有活性,但转化率较低,可能是由于底物上存在较强的空间位阻所致。增加酶浓度和孵育时间后,进一步提高了FucT转化率。
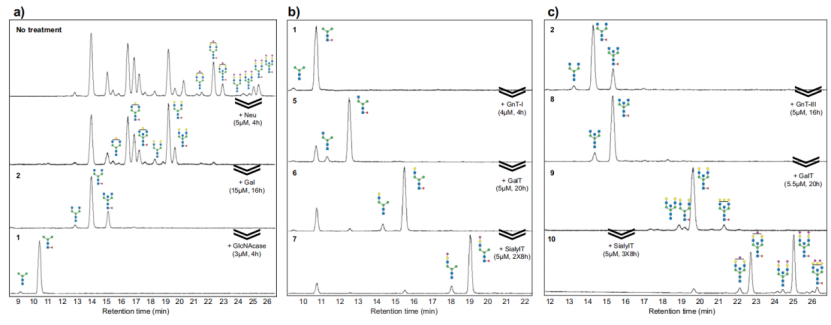
图3
4
重塑糖链
明确了如何用Neu、Gal处理将IgG聚糖转化为GlcNAc的糖型后(图3a),作者进一步进利用GlcNAcase将聚糖改造成甘露糖末端的核心结构。同样的,使用Neu和GalT产生以半乳糖为末端的聚糖(图4),而使用GalT个SialylT产生了了单唾液化和双唾液化的结构。作者以带有(F)M3聚糖的IgG作为样本,使用GnT-I、GalT和SialylT来构建单天线聚糖结构(图3b)。此外,作者利用从IgG中切下的末端唾液酸和半乳糖,通过GnT III转移至(F)A2聚糖上,使IgG聚糖完全转化为单天线聚糖结构(图3c),增加了IgG上单天线聚糖结构的数量。
 图4
图4
5
SPGR的生物相容性
为了验证SPGR与底物的生物相容性,作者分析了利用上述方法制备的IgG的物理性质。使用动态光散射(DLS)的尺寸分析显示,天然血清IgG和SPGR工程IgG之间没有显著差异,表明在重塑过程中,IgG没有发生变性或聚集(图5a)。它们的熔融温度(Tm)和聚集温度(Tagg)略有变化(图5b,c),推断这些变化归因于IgG结构的改变。
为了进一步检查SPGR工程IgG的完整性,作者使用竞争测定法测量了它们与Fc受体的结合能力。基于FRET的测定(PerkinElmer,Alpha)发现,SPGR不会破坏IgG的完整性及其与Fc受体的结合能力。此外,在该测定中,具有单天线糖型的IgG显示EC50值降低,表明对FcγR-I的结合亲和力增强。因此,可以通过糖工程微调由聚糖介导的IgG药物的免疫原性。
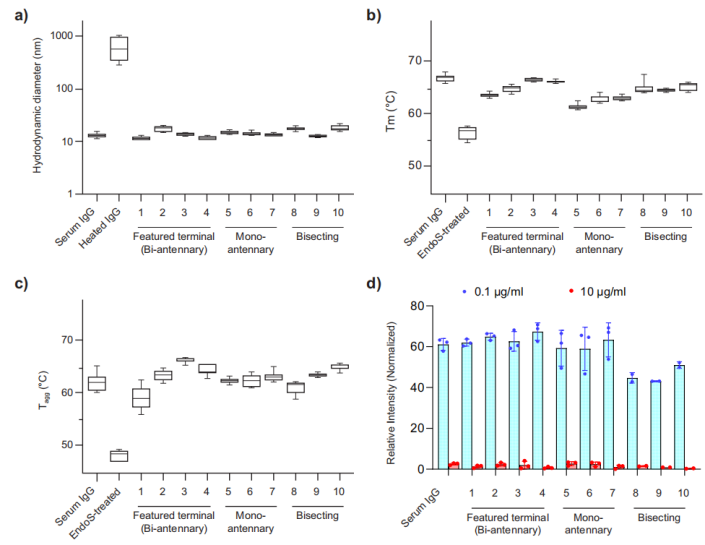
图5
参考文献:
Mann B , Hsu Y P , Verma D , et al. Successive remodeling of IgG glycans using a solid-phase enzymatic platform[J]. Cold Spring Harbor Laboratory, 2021.
来源于优宁维药物研发官网

