近日,The medicine maker 发表了一篇很有意思的文章《mAbs: Not so Sweet》,讲述了抗体的糖型的复杂性与如何调节岩藻糖修饰,提升药效。本文挑选了精华部分进行翻译,并将为您介绍岩藻糖基化缺陷的CHO细胞宿主如何助力增强基于单克隆抗体的生物治疗药物的药效。
早期的单克隆抗体生产,核心挑战之一是产品滴度低,这一问题已被不断开发的宿主细胞系和工业生物生产技术的广泛进步所克服,包括优化培养基,补料方案和工艺培养条件的过程优化。随着对开发和制造单克隆抗体的需求不断增长,监管机构对批准人类使用的生物治疗药物提出了更高要求:包括控制关键质量属性(CQA)。目前大量投资专注于解决新的难点:产品质量属性的一致性。
单克隆抗体翻译后修饰(PTM)中的糖基化,就是一个很重要的CQA。糖基化是一种酶促过程,涉及将寡糖结构添加到多肽的特定氨基酸位点以形成糖蛋白。这种基于非模板的合成过程发生在内质网和高尔基体内,然后再易位到细胞其它部位或分泌到胞外。糖基化有多种形式,最常见的是N-和O-连接的糖基化:
在N-连接糖基化中,寡糖连接到共有序列Asn-X-Ser/Thr中天冬酰胺(Asn)残基的酰胺氮,其中X是除脯氨酸之外的任何氨基酸;
在O-连接的糖基化中,寡糖连接到氨基酸如丝氨酸(Ser)、苏氨酸(Thr)或酪氨酸(Tyr)的羟基的氧原子上。
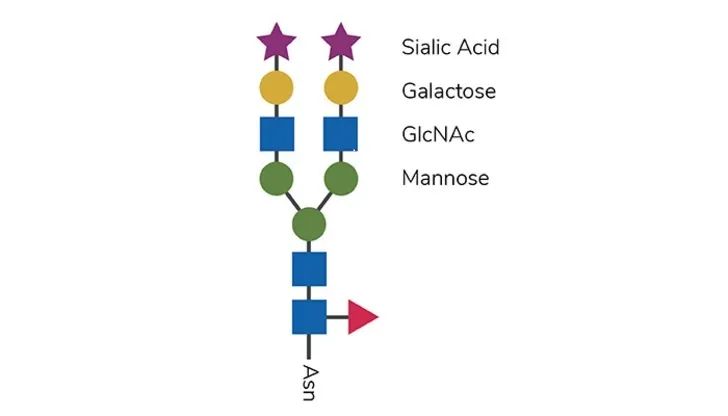
图 1 聚糖核心结构。抗体呈现的聚糖核心结构(参见图 1)包含 N-乙酰葡糖胺(GlcNAc)和甘露糖,其上添加了其他糖残基,例如半乳糖、唾液酸和岩藻糖。
为什么糖基化在蛋白质中如此重要?
大约70%的哺乳动物蛋白质是具有N-连接聚糖的糖蛋白,这通常赋予多肽链特定的特性。治疗性蛋白N-糖基化的变化会对蛋白质折叠、稳定性、药代动力学、免疫原性甚至作用模式产生重大影响。这种影响与mAb尤其相关,其中CH2结构域中存在的N-聚糖结构的可变性决定了细胞介导的反应,包括抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)。鉴于特定聚糖对生物制剂治疗效果的影响,生物制药中糖基化谱的控制是一个非常重要的话题。
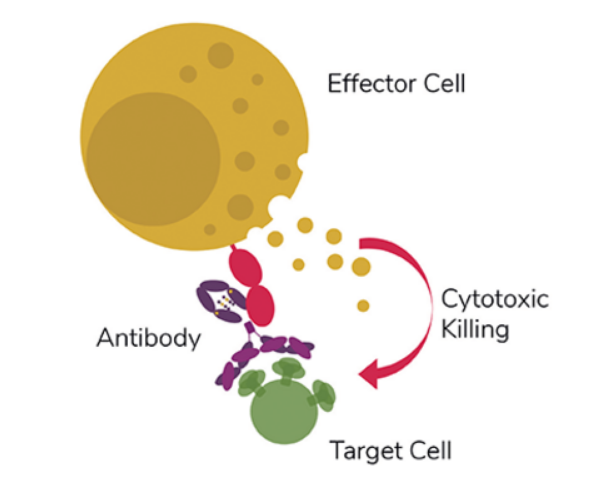
图 2 由效应细胞介导的ADCC:ADCC是通过mAb与效应细胞上的CD16受体结合介导受体对靶细胞做出一系列杀伤反应。
ADCC反应主要由自然杀伤(NK)细胞(也称为效应细胞)表达的FcγRIIIa(CD16)受体介导。识别“靶细胞”表面上特定配体的抗体可以通过抗体的Fc区与NK细胞的FcγRIIIa受体之间的相互作用激活NK细胞,从而释放细胞毒剂,最终消除靶细胞(见图2)。ADCC反应的强度取决于FcγRIIIa受体和抗体之间的亲和力。结构研究表明,IgG1-Fc上核心聚糖结构中岩藻糖的存在降低了IgG1与FcγRIIIa受体的结合亲和力。因此,去除抗体聚糖结构中的核心岩藻糖(称为无岩藻糖基化)是肿瘤治疗中特别重要的策略。
无岩藻糖基化抗体的优点包括:
针对表现出低抗原表达水平的肿瘤,可引发有效ADCC反应。例如利妥昔单抗,它已被证明对CD20表达降低的淋巴瘤效果较差 。无岩藻糖基化mAb能够有效引发针对抗原表达水平低的细胞的ADCC反应,这为目前不适合的肿瘤学靶标的有效治疗方法打开了大门。
减少血清IgG在结合(和激活)FcγRIIIa受体方面的竞争。临床环境中的证据表明,治疗性抗体可被循环IgG竞争FcγRIIIa受体结合所抑制。因此,需要更高水平的治疗性抗体来克服这种竞争,这可能会带来并发症和不良副作用。使用非岩藻糖基化抗体可以通过增加与FcγRIIIa受体的结合亲和力来减少这种竞争。
通过解决这两个因素,非岩藻糖基化抗体可以提高生物药物的效力、扩大其治疗窗口以及由于所需剂量的降低,可减少与治疗相关的不良副作用和并发症。
糖工程单克隆抗体的使用不仅限于肿瘤治疗。补体依赖性细胞毒性(CDC)也受糖基化模式的影响;表现出低或无半乳糖和高甘露糖的抗体显示与补体成分 1q(C1q)复合物的结合减少,导致 CDC 反应降低。此外,高度唾液酸化的抗体可以介导自身免疫性疾病中的抗炎反应(8)。
鉴于糖基化对治疗性抗体和 Fc 融合生物治疗剂介导的效应子功能的重要性,用于表达此类产品的宿主细胞系可以被设计为产生选择性糖型,进而调节其特定的生物活性。
来源于优宁维药物研发官网

