腺相关病毒 (AAVs) 于 20 世纪 60 年代中期被研究者发现,近年来已成为基因治疗的主要载体。它具有许多理想属性:安全性好、免疫原性低、能感染分裂细胞和非分裂细胞、能介导基因长期稳定表达等1。尽管目前已有两款 FDA 批准的基于 AAV 递送技术的基因治疗产品,取得了重大临床和商业成功,但病毒载体的成本效益仍然是一个挑战。本文主要介绍了 AAV 市场需求、下游生产路线、AAV 稳定性及降解途径,为提高 AAV 生产效率提供思路。
病毒载体的市场趋势及需求
在过去几年中,AAV 基因疗法商业化成功案例大大增加了国内外细胞和基因疗法的热度。在全球范围内,有超过 2,400 项 CGT 临床试验正在进行中2。由于 CGT 的开发时间比传统生物药更短,并且可以遵循加速的监管审批途径,因此 CGT 和 RNA 治疗市场持续扩大。自 2021 年 Q1 以来,仅基因治疗管线就增长了 16%,从临床前到注册前阶段,有 3,579 种 CGT 和 RNA 疗法正在开发中2。不断增长的市场需求要求生产技术迅速发展,以及病毒载体基因疗法应用不断扩大,如应用于更常见的疾病,及提高病毒产量、降低成本。
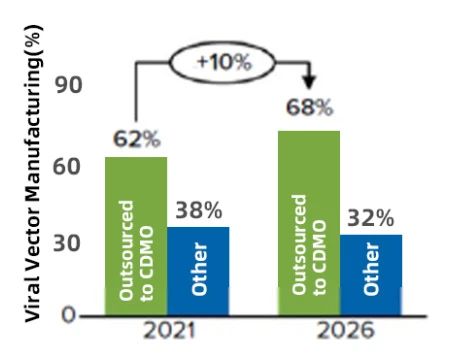
图1. 5 年内病毒载体的 CDMO 需求预测
2022 年 2 月的 ISR 调查报告显示,大约 25% 的生物制药或小分子企业没有 CGT 生产能力,对病毒载体的外包需求较高。62% 的公司通过 CDMO 增强其病毒载体生产能力,预计未来五年这一需求将保持稳定,到 2026 年略微上升至 68%(图 1)。正在开发中的基因疗法中,有 89% 的项目使用病毒载体递送,其中 AAV 和 LV 载体是最常用的(图 2)。病毒载体生产在整个行业中并未标准化,创建一个标准化工艺平台可以最大限度地减少开发工作和复杂性,有助于加速临床产品的 GMP 生产。
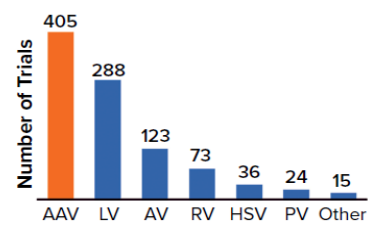
图2. 用于临床开发的病毒载体类型
AAV 下游关键挑战和层析工艺方法
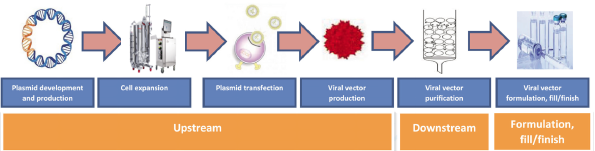
图3. AAV病毒载体生产工艺流程
AAV 病毒载体的生产是一个复杂的过程(图 3),需要创新的方法来满足安全性和有效性要求、临床和市场需求以及商品成本目标。制备稳定的病毒载体,防止其在生产、储存过程中降解,保持其长期稳定性和功效是 AAV 生产者面临的主要挑战。
1
AAV 下游工艺流程
下游工艺包括从工艺和产品相关杂质中纯化病毒颗粒,去除宿主细胞、质粒 DNA 和空壳病毒等杂质。近年来,已经开发出了纯化 AAV 载体的步骤,但下游工艺占病毒生产总成本的很大一部分,因此需要更具有成本效益地生产 AAV,采用一种有效且可重复的方法来生成高纯度的病毒载体。

2
AAV 下游关键挑战
主要挑战在于细胞裂解、过滤、层析,这些步骤通常缺乏高效且通用型的方法。
a) 细胞裂解:从细胞中释放 AAV 载体的基本技术是重复冷冻/解冻,然后低速离心,然而该技术不适合大规模纯化。机械匀浆使用高剪切力导致膜破裂,尽管可放大,但由于剪切力引起的聚集和沉淀,经常导致产品损失。Triton X-100 作为裂解去垢剂能提供足够产量,然而研究表明 Triton X-100 会产生毒性,并于 2016 年 12 月被欧洲化学品管理局列为高度关注物质 (SVHC)3 。因此,需要一种替代的细胞裂解方法,不仅能够充分裂解细胞,还可以保护 AAV 在纯化过程中免受压力。
b) 过滤:过滤是 AAV 下游工艺中最昂贵的操作步骤,它可能导致 AAV 颗粒聚集或由于过滤过程中的剪切力而失活。细胞裂解产生大量细胞碎片,难以通过滤器,优化滤器以实现高通量回收仍然是一个挑战,它还取决于 AAV 血清型。连续过滤作为一种分离技术可能会减少过滤器堵塞,但实际应用还不多。由于基因治疗产品缺乏合适尺寸的滤器,过滤过程中滞留量大和产品损失也是一个问题。
c)层析方法:典型的层析方法包括亲和层析、离子交换色层析。虽然亲和层析能够产生高产量的 AAV,但它无法区分空壳和完整衣壳。层析的挑战之一是每种 AAV 血清型都需要特定亚型的纯化方法,需要一种实现最佳产量,同时保持产品效力和完整性的层析方法。此外需要各个阶段尽量减少衣壳蛋白的物理和化学降解(如聚集、蛋白水解、氧化和脱酰胺),以免影响病毒感染效率。
3
AAV 下游平台工艺方法
目前最主流的 AAV 层析方案采用两步工艺:
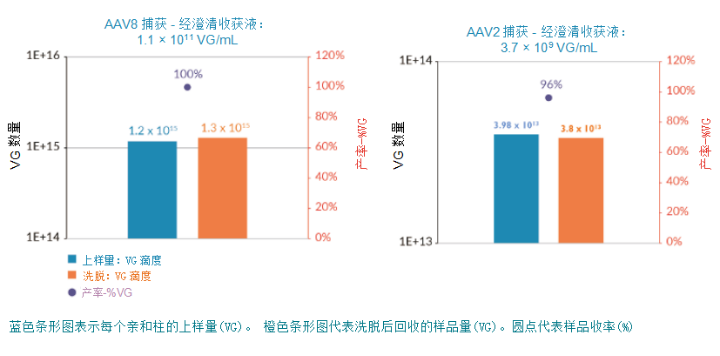
图4. AAV两步法层析流程
第一步:亲和层析从细胞裂解物中捕获 AAV 病毒
POROS CaptureSelect 系列亲和填料具有广泛的选择性、高载量和洗脱回收率(单步即可获得 >90% 的回收率和 90% 的纯度) ,以及良好的可放大性(图 5) ,POROS CaptureSelect 系列亲和填料优势如下:
a) 通用性广,适用于多种 AAV 亚型的纯化,捕获 AAV 能力强
b) POROS基架具有较大的流穿内孔,可快速纯化大量细胞裂解液
c) 填料可在不同流速下使用,不影响载量、分辨率和纯度,极大增加了工艺设计灵活性
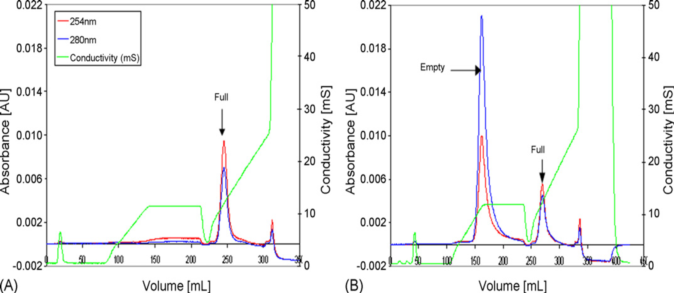
图5. POROS CaptureSelect AAVX 捕获 AAV8(左)和 AAV2(右)的产率
第二步:使用 POROS HQ 填料进行空壳和实心病毒分离
将 AAV 样品上样在 POROS HQ 柱上,然后使用醋酸钠线性梯度洗脱。以 A280 吸收特征峰的空衣壳,比 A260 吸收特征峰的实心病毒洗脱更快。空壳和实心病毒以 16:1 的比例混合后,又在相同的梯度条件下使用 HQ 层析柱纯化,首先出现空壳峰,然后出现基线分离的实心峰,展示了填料的高分辨能力,为 AAV 空衣壳的去除提供了一种可行且可扩展的工艺。(图 6)
图6. POROS HQ 分离 AAV 空壳和实心病毒颗粒
AAV 的稳定性及降解途径
AAV 降解可分为两大类:物理途径和化学途径。病毒载体的降解取决于溶液条件,特别是 pH 值、离子强度和原料污染物,以及温度、剪切力、冻融和光照等外部因素。
1.AAV 载体会通过变性/展开、聚集、表面吸附这三种物理途径发生降解,引起高阶结构的变化。物理不稳定性会对产物稳定性和转导效率产生不利影响,如果降解产物由于其非天然结构而具有毒性或免疫原性,则 AAV 制剂的安全性也会受到损害4。
2.AAV 载体也会通过二硫醚交换、脱酰胺、氧化和脱落等化学修饰途径,产生新的结构,影响载体的安全性和有效性。化学降解通常会改变蛋白质的物理性质,例如静电、疏水性、二级和/或三级结构,以及热力学和动力学展开/折叠屏障5。
病毒载体的稳定性和临床性能可以通过化学修饰来改变。例如,用丙氨酸或精氨酸对 AAV2 衣壳中的丝氨酸、苏氨酸和赖氨酸残基进行突变已证明可以提高转导效率6。将叠氮化物部分引入 AAV 衣壳蛋白中,然后通过正交和化学计量缀合多种化合物,通过点击化学添加聚乙二醇 (PEG) 已证明可将混合人血清中的稳定性提高 1.7 至 2.4 倍,并且抗体识别能力降低近两倍7。在中和抗体存在的情况下,与 PEG 2000 缀合的 rAAV2 在 1000:1 的比例下显示转导效率增加 2.3 倍8。
小结
本文主要讨论了 AAV 的下游生产路线、AAV 稳定性及降解机理,并为提高 AAV 生产效率提供思路。采用亲和捕获和阴离子精纯两步方案,建立一个简化和可放大的 AAV 层析过程,获得高纯度的 AAV 产品。相信随着行业经验的增长和平台方法的不断开发,AAV 下游工艺会变得更加高效、标准化。
来源于优宁维药物研发官网

