估计看到这个标题,可能很多人会说液相探针杂交捕获我听说过,但是这个技术到底是什么,具体的流程是怎么样的,可能就不是那么清楚了。那今天小编就带你一张图了解液相杂交捕获实验的整个过程,话不多说,我们直接上图。
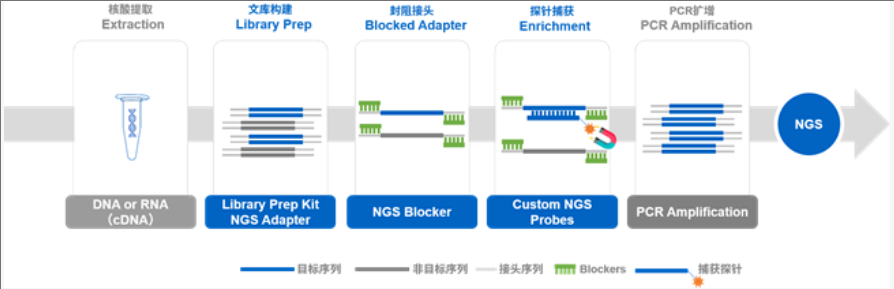
实验大致流程是:
提取核酸—完成NGS文库构建—探针+NGS文库+Blocker冻干—杂交缓冲液内进行杂交(其实就是退火,形成新的探针+单链目标文库的半双链结构)—洗脱—PCR扩增—NGS测序。
乍一看,流程就很复杂,操作估计也不是很友好,而且耗时较长,一轮实验下来,一天半,甚至更久。另外需要辅助的仪器设备,例如冻干机。为了防止交叉污染/气溶胶污染,实验室还需要严格划分不同的功能区。看到这估计很多小伙伴就会问了,这个技术到底有什么优势,在前期准备这么复杂的情况下,还依旧有那么多的实验室和公司选择这个方法来进行研究呢?
那么下面我们就来着重介绍一下这个液相杂交捕获技术的优势吧。
液相杂交捕获技术的优势
相比多重扩增技术,其受限于引物设计原则,很多区域是无法设计多重扩增引物的,比如基因融合的情况,又比如Indel缺失的区域。但是液相杂交捕获技术就不用担心这些问题。研究表明,一条120 nt的捕获探针,只要其中80 nt和目标DNA分子互补配对了,就可以形成较为稳定的双链结构,从而被捕获到,更关键的是,80 nt互补区域,也并不要求每个碱基都互补配对,它是允许一定程度的Mismatch的。
最常见的一个例子就是人类全外显子捕获试剂盒,其探针可以覆盖40-60 M的外显子区域。小的Panel,像人线粒体Panel,只有134条探针,可以捕获人线粒体全长序列。多重扩增显然无法扩增人全部外显子,市面上达到1000重以上的多重扩增Panel还是相对少见的。上述这两个例子可以说明,液相探针杂交捕获适用范围广。
这个就比较好理解了,比如有8个DNA样品,分别需要进行杂交捕获实验,可以先构建8个NGS文库,混合在一起,进行一次杂交捕获,就可以了。为啥?因为8个NGS文库在构建的过程中已经分别加上了不同的UDI标签了,杂交过程并不改变其UDI序列,最后测序也可以分割出8个样品的数据。不过需要注意的是,通常这样做的是目的为了找遗传突变。
相比多重PCR,其很难添加真正意义上的UMI标签,用于消除扩增,测序过程容易引入的错误突变。但是,液相杂交捕获技术,由于其先连接建库的原因,UMI分子必然是可以提前连接到每个目标分子两侧的,UMI技术加上超高深度的NGS测序数据,可以检测低至0.1%甚至更低的体细胞突变。为研究肿瘤细胞异质性提供了有力的工具。
多重PCR引物一旦固定后,很难再未经严格评估测试的情况下,添加新的引物到原有扩增体系内。但是液相探针,经过合适的设计,是可以添加新的探针的,前提是计算好合适的浓度,并且新的探针设计要符合一定的规则。
到这里相信小伙伴们应该对液相杂交捕获有了一定的了解,如果后续想要进一步了解有关靶向捕获技术的相关信息,可以持续关注我们靶向捕获测序的专题文章哦!
生工推荐
生工生物工程(上海)股份有限公司自2011年成立高通量测序部以来,逐步引进了Illumina,Life,DNBSEQ,PacBio、Nanopore、等二代/三代测序平台。建立了2000平米高标准实验室(通过了国家ISO认证)并搭建了50PB级存储及运算能力的服务器集群,能满足绝大多数科研客户的研究需要。同时,生工高通量测序团队建设也在不断完善中,目前有100余专职员工,其中高级技术人员以及高级生物信息工程师占比50%以上,10年来,通过生工高通量测序服务所发表的文章累计影响因子在10000分以上。
生工生物现可提供多种靶向捕获测序服务,感兴趣的小伙伴欢迎来电与我们技术支持沟通。
技术支持联系方式:021-3777 2413。
.png)

