在免疫组化实验中,抗体的选择、多重荧光标记方案的设计以及成像分析往往是研究者的关注重点。但若忽视实验对照的设置,实验结果的可信度和可重复性将大打折扣。以下是膜蛋白专家Alomone总结的四大关键对照类型,助您获得精准可靠的实验数据。
一、一抗阴性对照(No Primary Control)
适用场景:间接法检测(一抗+标记二抗体系)
操作方式:实验流程中仅省略一抗孵育步骤,其余步骤不变。
作用解析:若此时仍出现阳性信号,提示二抗存在非特异性结合(如与组织内源性免疫球蛋白结合)。此对照可快速验证二抗的特异性,必要时需更换二抗。
二、阻断肽对照(Blocking Peptide Control)
原理:利用过量抗原肽(免疫原)与一抗预孵育,竞争性封闭其抗原结合位点。
操作方式:将一抗与阻断肽按比例混合后孵育,再按常规流程染色。
结果判读:若目标信号显著减弱或消失,表明一抗特异性良好;若仍有染色,则提示抗体存在脱靶结合(如交叉反应或非特异性吸附)。
点击此处查看优宁维可提供的
跨膜蛋白抗体相关Blocking Peptide
三、阴阳性组织对照
❖
阳性组织对照
选择依据:已知目的蛋白高表达的组织(如肿瘤标志物在肿瘤组织中的表达)。
验证意义:若阳性对照未显色,需排查抗体失效、抗原修复失败或实验操作问题。
❖
阴性组织对照
理想样本:基因敲除(KO)或敲低(KD)组织。
替代方案:若无法获取KO/KD样本,可参考蛋白质图谱数据库(如The Human Protein Atlas),选择目标蛋白天然低表达或不表达的组织作为对照。
验证意义:若阴性对照染色,则很可能是抗体的非特异性结合
四、内源性背景对照
很多组织会天然产生一定程度的背景染色或自发荧光。胶原蛋白和弹性蛋白是主要干扰源,此外嗜酸性粒细胞、脂褐素及某些胚胎组织(如卵黄)也会造成类似问题。
针对组织自发荧光或内源物质干扰,建议采取以下策略:
预判本底:拍摄未染色样本的自发荧光,明确背景干扰区域。
固定优化:使用丙酮:甲醇(1:1)混合固定液,可降低部分组织自发荧光。
淬灭剂处理:苏丹黑等染料可淬灭特定波长荧光,但可能影响目标信号强度。
光谱校正:多色荧光实验时,通过光谱拆分区分目标信号与背景。
实验对照的设置是数据解读的重要依据,也是不同批次实验结果可比性的基石。对于诊断级IHC,建议参考Torlakovic等学者提出的标准化方案(PMID: 26286753)。若需抗体特异性验证,可遵循Uhlen团队提出的"五支柱验证法"。
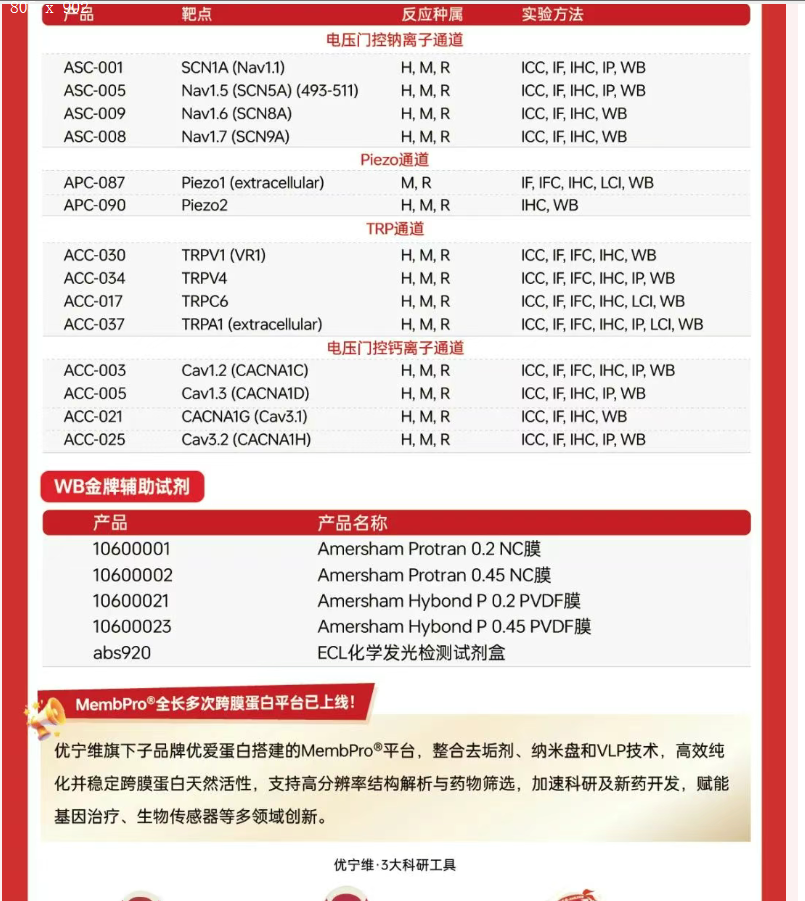
Alomone Labs,深耕膜蛋白(尤其是离子通道)研究工具,包括抗体、工具化合物及毒素的研发,致力于提供高品质的产品,帮助您获得更可靠的实验结果。3月24日-4月30日,购买Alomone参与活动的抗体任意2支,即可0元加购第3支抗体,帮助您用有限的经费实现更多靶点的研究。


Alomone提供完整IHC操作流程(含直接/间接法详细步骤)及常见问题解决方案,如有需要请联系小助手索取。
优宁维官方互助社群集结号
目前优宁维已开通官方WB、细胞、蛋白纯化及Biacore互助交流群,扫码添加优宁维实验小助理微信,发送您的单位、姓名及想要加入的社群名称即可入群,群内可抢先获知小优大学堂精彩课程表,还可获得各种实用的实验Tips,享受技术专家在线答疑,并且还有不定期的专属群福利,赶紧来加入吧!

