随着ssDNA在化学传感器、核酸适配体等领域的应用,越来越多的研究者需要高纯度的长链ssDNA,有些ssDNA使用传统的化学合成方法并不能满足纯度、长度的需求,因此,研究者们开发出了多种ssDNA的生物学合成方法,包括:不对称PCR扩增法、酶解法、磁珠法、特殊引物扩增法等等。
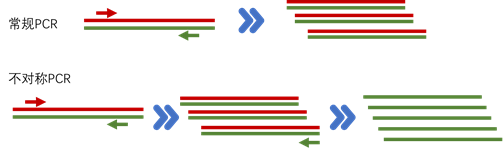
很多小伙伴们认为PCR的产物是双链DNA,但并非如此,实际上,PCR的产物是ssDNA。传统的PCR通过正反向引物的扩增,得到了等量、等长且反向互补的ssDNA,在最后的反应循环退火成为了双链DNA。
那么不对称PCR,就是通过调整参与扩增的正反向引物的比例,使得正反向引物的量不一致,通常为50~100:1,达到制备ssDNA的目的。首先,含量少的一条引物会在PCR前几轮反应中迅速耗尽,接下来的PCR循环中,含量多的引物将以前几轮的扩增产物为模板,持续产生ssDNA产物。然后,通过电泳手段,将产物中的ssDNA纯化出来。
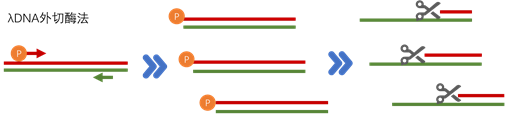
酶切法主要用到的是λDNA外切酶,该酶能够作用于双链DNA,沿着5-3的方向逐步切去5’单核苷酸。λDNA外切酶会优先降解末端含有5’磷酸基团的双链DNA,因此,当双链DNA的一条链有5’磷酸基团而另一条没有时,该酶将从磷酸化末端优先降解这条链,从而剩下没有5端磷酸的那条ssDNA。
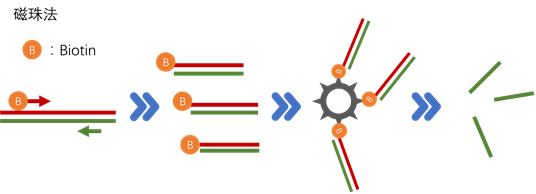
磁珠法采取的策略于酶切法类似,酶切法根据PCR产物的两条ssDNA性质不同,利用特殊的外切酶特异性地将一条ssDNA切除,留下目的ssDNA。而磁珠法则是利用两条ssDNA的性质不同,将其中一条固定住,分理出另外一条目的ssDNA。
例如,利用生物素和链霉亲和素之间较强的非公价相互作用及磁珠在磁性环境下易于操作的优点,将不需要的那条ssDNA固定住。首先,利用Biotin标记的引物与常规引物进行PCR扩增,获得单端生物素化的dsDNA,然后,与链霉亲和素磁珠孵育,形成dsDNA-生物素-链霉亲和素-磁珠复合物,最后,使dsDNA解链,释放出不带生物素标记的ssDNA。
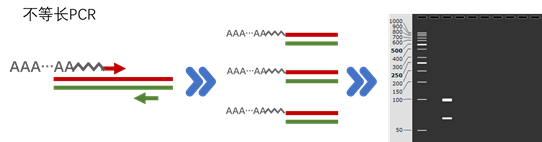
前面说过PCR是通过正反向引物的扩增,得到了等量、等长且反向互补的ssDNA,既然能通过不对称PCR得到不等量的ssDNA,那么可否通过某种手段得到不等长的ssDNA呢?答案是可以的,就是通过特殊的引物设计,进行不等长PCR扩增,得到不等长的ssDNA,然后就可以轻松通过PAGE电泳将不等长的ssDNA进行分离和回收。
特殊的引物设计方法有两种:1. 引物的5端添加spacer修饰,再接上一串polyA来增加长度。通常用到的spacer为Spacer18修饰:
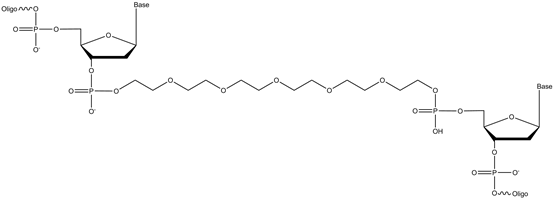
这个修饰可以阻断DNA聚合酶的延伸,再加上后面添加的polyA,就可以得到不等长的ssDNA产物。
另外一种引物在一段额外添加一段富含GC的区域,这段区域具有较高的Tm值,使其在PCR的延伸阶段仍能保持茎环结构,从而阻断另一条链的延伸,使得正义链和反义链形成长度差异。
除了上述常见方法,还有一些基于上述方法的组合应用,例如使用不对称PCR和磁珠法结合来制备单链ssDNA等。这种组合能够帮助研究者们克服单一方法遇到的ssDNA难以分离,纯度不高等问题。
可以看出,上述方法的核心都是基于PCR扩增,然后用不同的方式将PCR产物中的两条ssDNA进行分离或者消除,相信随着生物技术的不断完善,必将出现更好的ssDNA制备方法,为需要ssDNA的广大科学研究者们添一把力。

