外泌体一直最热门领域研究的重点,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等方方面面。有研究表明肿瘤来源的外泌体参与到肿瘤细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了肿瘤的生长与侵袭。慢性淋巴细胞性白血病(CLL)是影响成年人的最普遍的白血病,目前仍是无法治愈的疾病。
此文针对CLL外泌体对体内基质细胞影响,分析其对癌症的影响。今天分享的文章摘自《Blood》的《Exosomes released by chronic lymphocytic leukemia cells induce the transition of stromal cells into cancer-associated fibroblasts》。
1.CLL外泌体在体外和体内被MSC,EC和髓样细胞积极整合
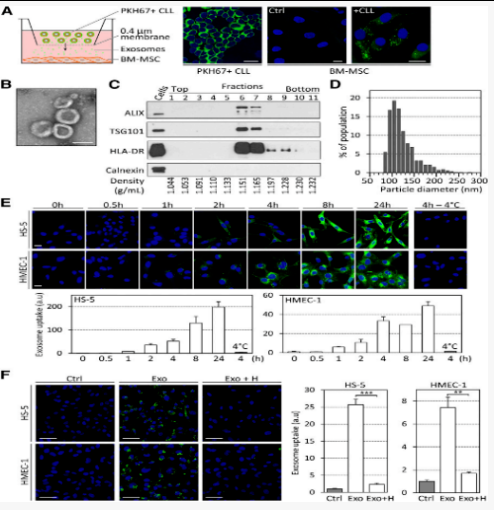
图1
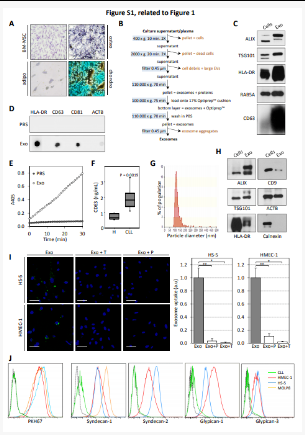
补充图1
CLL细胞分泌外泌体,该外泌体迅速进入培养的基质细胞
作者为了验证CLL外泌体在体外和体内被MSC,EC和髓样细胞是否积极整合,在培养插入物中PKH67标记的原代CLL细胞与BM-MSC共培养24小时(图1A)观察到膜囊泡从CLL细胞转移至BM-MSC; 补充图1A)。通过将样品离心分离和过滤确定了外泌体从CLL细胞中释放出来与CLL微环境中的BM-MSC或其他细胞的通讯中起作用(补充图1B)。
采用来自MEC-1 CLL细胞系的外泌体(称为CLL外泌体),并使用源自刺激的原代CLL细胞的外泌体(称为原发性CLL外泌体)为原料,在荧光显微镜,蛋白免疫印迹实验分析不同培养体系和条件CLL细胞分泌外泌体细胞内相关因子(图1B-F,补充图C-D),在电子显微镜下呈杯状外观富集外泌体标记蛋白ALIX / PDCD6IP,TSG101,HLA-DR,RAB5A,CD63和CD81,与健康的供体血浆相比,CLL患者的血浆显示出更高的外泌体标记CD63水平(补充图1F)。
血浆外泌体显示出相似的大小和蛋白质标记(补充图1G-H)。通过在小鼠中静脉注射PKH26标记的外来体在体内鉴定了外来体靶细胞。注射后18小时内,外泌体积聚在骨髓,外周血白细胞,脾脏和肝脏的CD31 +细胞中(补充图2A)。将外泌体应用于小鼠BM细胞后发现,内皮祖细胞,髓样细胞和BM-MSC是微环境中外泌体靶向的主要人群(补充图2B-C)显示CLL细胞分泌外泌体,这些外泌体主要在肿瘤微环境中存在的各种良性细胞(包括EC,髓样细胞和BM-MSC)中在体外和体内被主动摄取。
相关产品
2. CLL外泌体将功能性microRNA和蛋白质转移至靶细胞
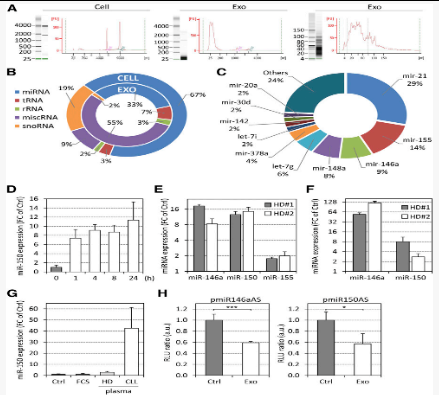
图2:CLL外泌体RNA的表征以及功能性miRNA转移至靶细胞
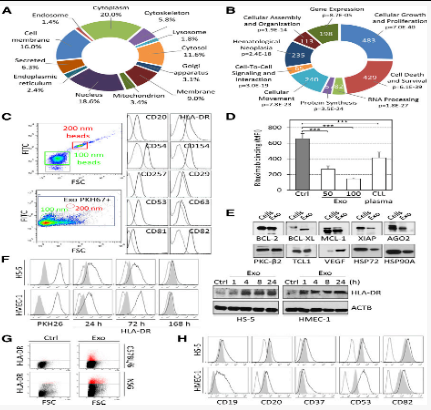
图3:CLL外泌体的蛋白质组学表征以及蛋白质向靶细胞的转移
作者表征了通过外泌体穿梭的RNA和蛋白质,以识别外泌体在CLL微环境重塑中的可能功能。通过不同条件处理比较CLL外泌体和CLL细胞的全RNA裂解物。发现在外泌体中观察到显着的小RNA种类占优势,而核糖体RNA缺乏(图2B—H)。
在不同时间和不同培养系中通过芯片和测序对不同RNA筛选分析。用CLL外泌体处理原代BM-MSC导致miR-150水平增加,miR-150水平在CLL血浆中非常丰富,并且 miR-146a和-150在靶细胞中具有功能(图B-H)。
从CLL外泌体提取的蛋白质的LC-MS / MS分析。表明丰富的蛋白质来自各种细胞区室,包括细胞膜,细胞质和细胞骨架(图3A))。在单颗粒水平上分析和免疫印迹分析证实了CLL外泌体中存在抗凋亡蛋白,血管生成因子,RNA加工蛋白,致癌基因或热休克蛋白(图3B-E)。
与RNA相似,外泌体蛋白也转移到受体细胞中,例如通过外泌体穿梭于基质细胞的人白细胞抗原(HLA)-DR分子的例子(图3F-G)。另外,通过免疫表型分析揭示了B细胞特异性标志物(CD19和CD20)和四跨膜蛋白(CD37,CD53和CD82)的转移及其在靶细胞表面的呈递(图3H)。
3.CLL外泌体在基质细胞中诱导炎性表型
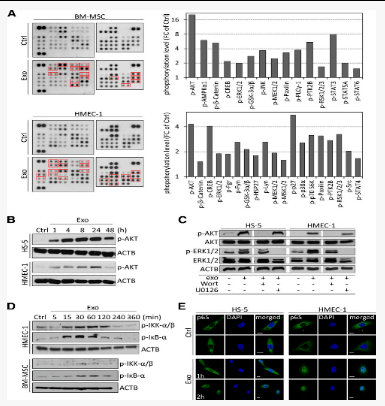
图4CLL外泌体可快速激活基质细胞中的激酶和NF-κB
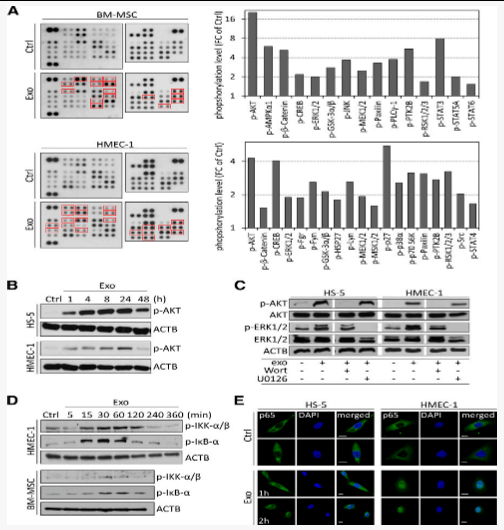
图5CLL外泌体改变基质细胞的转录组并诱导细胞因子和促血管生成因子的释放
作者评估了CLL外泌体诱导的表型变化,并确定了BM-MSC和EC中的活化信号通路。通过抗体芯片对对未经处理(Ctrl)或用50 µg / mL CLL外泌体(MEC-1; Exo)处理1小时的BM-MSC和HMEC-1细胞的蛋白裂解物进行磷酸激酶抗体阵列(左)。将细胞裂解物与含有对磷酸化激酶具有特异性的捕获抗体的膜杂交。
经AKT验证,磷酸化可保持≥24小时,表明在靶细胞中信号级联的强大而持久的激活。在AKT / ERK途径抑制剂存在下用外泌体进行的短期治疗(5分钟)表明,激酶的磷酸化是由蛋白质磷酸化的诱导而不是磷酸化蛋白质的转移引起的(图4A-C)。由于在靶细胞中激活的几种激酶与核因子(NF)-κB信号密切相关(例如AKT和GSK3β),因此我们评估了NF-κB的可能诱导作用。作者还发现kappa B激酶(IKK)α/β的抑制剂外泌体应用后15至30分钟,磷酸化和抑制性NF-κBα磷酸化,表明抑制性IκBα释放了NF-κB。免疫荧光染色证实了活性p65 /NF-κB迅速转移到细胞核中(图D-E)。
在原代BM-MSC中的基因表达谱和执行基因本体分析(IPA),我们确定了功能的主要变化,例如细胞存活,迁移和粘附,增殖,RNA表达和炎症(图5A)。CAF是各种癌症中支持肿瘤的微环境的主要成分,而CLL与炎症环境有关,从而导致了微环境依赖性的细胞增殖调控。因此,在CLL中基质细胞向CAF表型的改变是可能的。由于CAF介导的功能严格依赖于NF-κB信号传导,我们评估了转录组数据集与CAF表型相关的基因变化,并进行了无监督的分级聚类。先前描述的,CAF基因表达签名22,35 在与CLL处理的外来体的BM-MSC中观察到(图5B)。qRT-PCR分析以及随后的无监督分层聚类证实了编码细胞因子和趋化因子的基因(IL8,BAFF,CXCL1,LIF,IL6,IL32,IL34,CCL2和CCL5),抗凋亡因子(c-IAP2)和基因表达的差异迁移/入侵相关因素(CLDN1,EPSTI1,ICAM1和MMP1与健康供体B细胞相比,暴露于源自原代CLL细胞的外来体的BM-MSC中(图5C)。值得注意的是,通过qRT-PCR验证的几个基因已经与CAF基因签名相关联(CXCL1,IL6,IL34,CCL2,ICAM1和MMP1)。
相关产品
4.CLL外泌体可诱导离体和体内基质细胞的增殖和迁移及血管生成
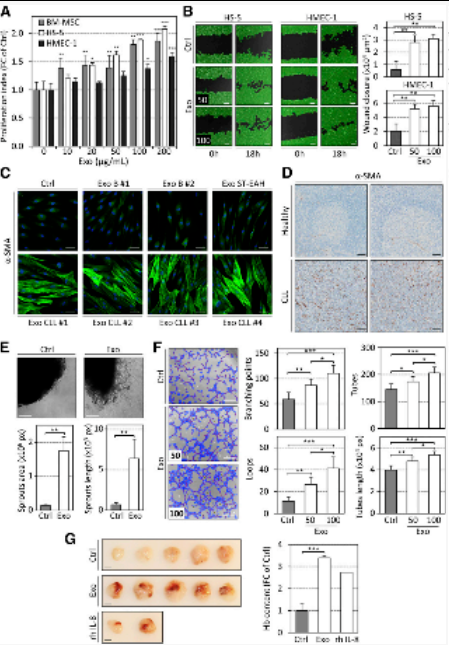
图6CLL外泌体在体外和体内促进细胞增殖,肌动蛋白细胞骨架重塑,细胞迁移和血管生成
在外泌体治疗中,我们注意到BM-MSC中基质细胞增殖的显著和剂量依赖性增加(图6A),迁移显著增强和惊人的肌动蛋白细胞骨架重塑。后者的定义是应力纤维的形成和平滑肌肌动蛋白(α-SMA)积聚,这是活化基质和CAF的特征。
当将细胞与外泌体一起孵育时,在基质细胞和成纤维细胞中观察到应力纤维的类似形成,以及RhoA的表达增加,RhoA是该肌动蛋白骨架重塑所必需的GTP结合蛋白。健康供体B细胞产生的外泌体不诱导α-SMA表达。重要的是,在CLL患者浸润的淋巴结中检测到高水平的α-SMA阳性基质细胞,与脉管系统无关,表明CLL中存在CAF。
由于血管生成在CLL的病理学中很重要,我们还评估了CLL外泌体对该过程的影响。CLL外泌体增加离体新主动脉微血管的形成,有利于内皮管的形成,并在体内诱导基质胶塞中血管的形成。为了概括CLL外泌体的分泌及其在更多生理条件下对BM-MSC的影响,我们在培养插入物中建立了BM-MSC与原代CLL细胞的长期共培养(30天),或每周用外泌体处理BM-MSC。
我们对Burkitt淋巴瘤细胞系Namalwa进行了类似的实验,基因表达分析表明,在插入物中共培养的CLL外泌体和CLL细胞在BM-MSC中诱导了相似的基因表达变化图(图6D)。我们确定如何将基因表达的变化转化为与CLL外泌体一起孵育的BM-MSC上清液中的蛋白质合成和分泌。细胞因子,趋化因子和促血管生成因子水平的增加(图5E-G)证实了外泌体治疗使BM-MSC转变为CAF表型。
5.CLL衍生的外来体增强体内肿瘤的生长
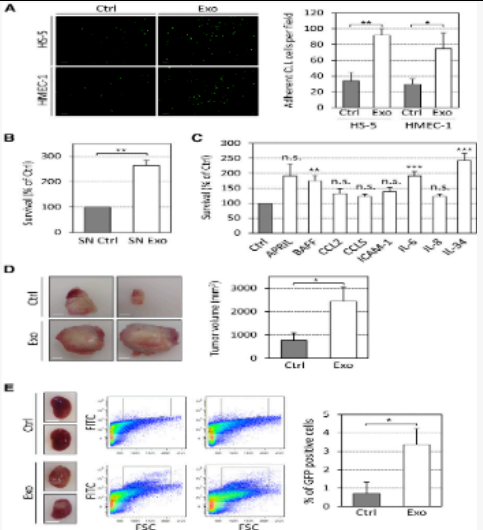
CLL外泌体增加CLL细胞在体外的附着力和存活率,并促进体内肿瘤的生长
将用PKH67染料标记的原代CLL细胞添加3小时到未经处理(Ctrl)或用50 µg / mL CLL外泌体(MEC-1;Exo)预处理的HS-5或HMEC-1细胞的培养物中。洗涤5次后,通过荧光显微镜拍摄图像,观察到CLL细胞与外来体处理过的基质细胞的粘附增加(图7A)。
并对CLL细胞与未经处理(SN Ctrl)或用50 µg / mL CLL外泌体(SN Exo)处理过的BM-MSC上清液孵育。6天后使用CCK8测定法评估细胞活力,血清培养基中放置18小时,观察到在外泌体刺激的BM-MSC上清液中培养6天的原代CLL细胞的存活率显着提高(图7B)。然后用指示的细胞因子(10 ng / mL)处理原代CLL细胞,并在6天后使用CCK8测定评估生存力,表明外来体处理过的基质细胞支持CLL细胞存活的能力增强(图7A)。
最后对小鼠皮下和肾脏及肾脏MEC-1-eGFP细胞30 皮下注射入免疫受损的NSG进行对比分析。MEC-1-eGFP细胞30 皮下注射入免疫受损的NSG小鼠体内研究了CLL外泌体对肿瘤生长的影响与注射外来体的肿瘤细胞相比,将细胞与外来体共注射导致肿瘤大小增加(图7D)。MEC-1-eGFP细胞在小鼠肾脏中的积累(图7E)也证实了在CLL患者中观察到肾脏受累。数据证明了CLL衍生的外来体在体内具有促肿瘤作用,并且在肿瘤细胞影响微环境增殖和促进血管生成时,它们在疾病的早期发作中具有重要意义
相关产品

总结:CLL外泌体在此过程中是重要的介质,并在体内促进肿瘤的生长。慢性淋巴细胞性白血病(CLL)的发病机理与肿瘤支持微环境和免疫系统功能异常密切相关。CLL外泌体通过刺激基质细胞诱导炎性和致瘤性环境(包括增加的血管生成)而具有致癌潜力,从而支持CLL细胞的存活和生长。
PS: 需要相关文献的可以下方留言或联系优宁维销售人员,我们会尽快联系您并将相关资料发送给您哦!

