文献分析
Literature Analysis
错配修复异质性缺失(MMR)蛋白表达:免疫组化和微卫星不稳定性(MSI)评估的挑战 Topic

研究要点
这篇发表于2019年The Journel of Pathology Clinical Research杂志上的文章主要研究了错配修复(MMR)蛋白的免疫组化(IHC)用于鉴定MMR状态:弥漫性阳性(完整 / 保留细胞核染色)或核肿瘤染色缺失(MMR蛋白缺失)。经NGS鉴定4例结肠腺癌和1例伴有异型增生的胃腺癌在四种MMR蛋白中至少有一种呈现异质性IHC染色状态。为了探讨这些染色状态的潜在分子机制,对相应区域进行了宏观解析、微卫星不稳定性(MSI)分析以及MLH1、MSH2、MSH6和PMS2基因的NGS和多重连接依赖探针扩增(MLPA)分析,包括MLH1甲基化分析。
在5例MMR蛋白丢失的病例中,有4例是MSI-H的。异质性的MMR- IHC 并不总是由于人为判断所致,与丢失区域的高度微卫星不稳定状态有关。
01
材料和方法介绍
患者信息
这篇文章中的研究的病例是基于2015年至2017年期间所有接受MMR检查的胃肠道肿瘤中发现的不寻常的异源性样本而选择的,共进行了389例结直肠癌切除手术。在389例患者中,有4例大肠腺癌 (例1-4) 及1例 (例5) 同时患有胰腺癌和胃腺癌的患者由于其存异质性MMR免疫组学现象,作为本次研究的案例。
(1)组织学分析
审查所有切除标本的HE染色切片。记录肿瘤类型、分级/分化等多项参数。根据美国癌症联合委员会(AJCC)第7版pTNM癌症分期手册对病例进行病理分期。
(2)免疫组化分析
IHC(MLH1、PMS2、MSH2和 MSH6) 取材于石蜡包埋组织切片,使用抗体: MLH-1,MSH-2,MSH-6和PMS2。所有四种抗体的预处理方案都相同:热诱导表位修复,染色。
瘤旁正常结肠隐窝上皮、淋巴样细胞和间质细胞作为内阳性对照。
异质性染色的肿瘤表现为腺体内的异质性(强免疫反应细胞与阴性细胞混合)和/或带状缺失(涉及多个相邻腺体的融合区域的染色缺失)。使用相同的区块在每个病例上重复两次IHC。根据上述方式标记为MMR异质性的所有病例中,肿瘤细胞的核染色明显消失,而正常间质和淋巴细胞在同一区域显示较强的核染色。
(3)MSI分子检测
病例1-4,对正常组织和大肠腺癌患者的两个肿瘤区域进行了MSI分子检测。对MMR-IHC染色不均的肿瘤区分别进行大体解剖,使每例保留IHC的肿瘤区和缺失的肿瘤区分别进行MSI和NGS检测。病例5,对正常组织、胰腺肿瘤、胃腺癌和胃非侵袭性胃不典型增生/腺癌进行了分子检测。对所有病例的正常组织和大体解剖肿瘤区域的MSI分子检测结果进行了比较。
用Maxwell 16 FFPE LEV DNA纯化试剂盒(Promega)提取的基因组DNA进行MSI分子测试。MSI分子测试由一个用于评估MSI的多重PCR 5个微卫星单核苷酸标记(NR-21、BAT-26、BAT-25、NR-24、Mono-27)和两个主要用于检测潜在污染的五核苷酸标记(Penta C、Penta D)组成(MSIAnalysis System Version 1.2;Promega)。扩增片段用毛细管电泳法分离,用数据分析软件分析。如上所述,MSI分子分析是在所有病例的正常组织和两个肿瘤区域上进行的,并将正常组织和大体解剖的肿瘤区域之间的标记重复进行比较。MSI被定义为与正常样本中的同一标记相比,最高峰位移位超过两个碱基对。五个单核苷酸标记中有两个或两个以上的不稳定性被归类为MSI-H,一个单核苷酸标记的不稳定性被归类为MSI-L,无不稳定的被归类为MSS。
(4)二代测序
对1-4例的正常组织和两个肿瘤区域进行NGS测序。对MMR IHC染色不均的肿瘤区域分别进行大体解剖,使IHC保留和IHC缺失肿瘤区域均接受NGS测序。对第5例正常组织、胰腺肿瘤、胃浸润性肿瘤和胃非侵袭性增生粘膜进行了NGS测序。所有病例均按上述方法提取基因组DNA,并对正常组织和两个肿瘤区域进行NGS。
52个癌症相关基因,包括 MLH1、MSH2、MSH6 和 PMS2,在NGS仪器上进行双端测序。
(5)一代测序
对2例(案例2和案例4)的两个肿瘤区域进行Sanger测序。
循环条件为94℃变性1min,95℃变性30s,55℃ 30s,72℃ 1min循环35次,72C最终伸长率为5min。数据结果使用序列分析软件进行分析。
(6)MLPA和MLH1甲基化分析
为了鉴定外显子缺失和重复,在大体解剖的肿瘤标本上进行多重连接依赖性探针扩增(MLPA),包括进行甲基化特异性MLPAFormlH1甲基化分析,使用数据分析软件进行分析。病例 1 和 3 MLPA 采用探针MLH1 (P003) ,病例1和2 采用探针PMS2 (P008),病例4和5 采用探针MSH6 (P072),病例1和3 采用探针甲基化 (ME011) 评估 MLH1 启动子区域甲基化程度。
02
结 果
(1)组织学分析结果
组织学参数和pTNM分期如表2所示。所有4例大肠腺癌均为直肠癌,其中3例高分化,1例低分化。粘液分化2例(间质细胞外粘液含量>10% 但<50%),案例5为浸润性胰腺导管癌和胃腺癌,并伴有粘膜表面高度不典型增生。
表2. 临床病理特性
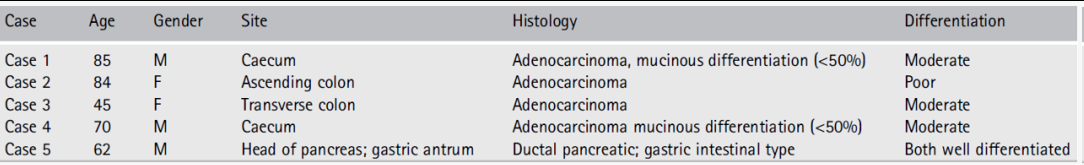
Note: 上表引自原文。
(2)免疫组化分析结果
MMR IHC染色的异质性(至少10%的肿瘤中存在异质性),在2%的结直肠癌切除(233例中有5例)中存在该现象,表3概述了MMR免疫组织化学结果。
表3. MMR免疫组化结果
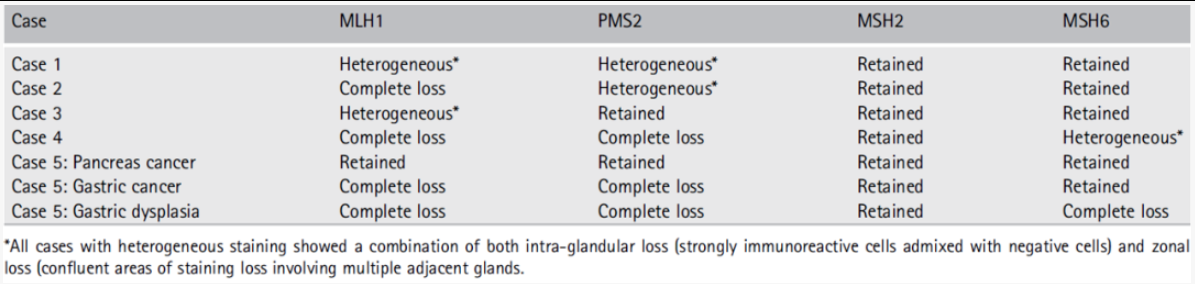
Note:上表引自原文。
病例1显示MLH1和PMS2的不均匀染色,MSH2和MSH6蛋白的完整染色(图1),其余3例(例2、3、4)均显示一种MMR蛋白完全缺失和/或异质染色:MLH1、PMS2或MSH6,其余三种MMR蛋白染色完整。
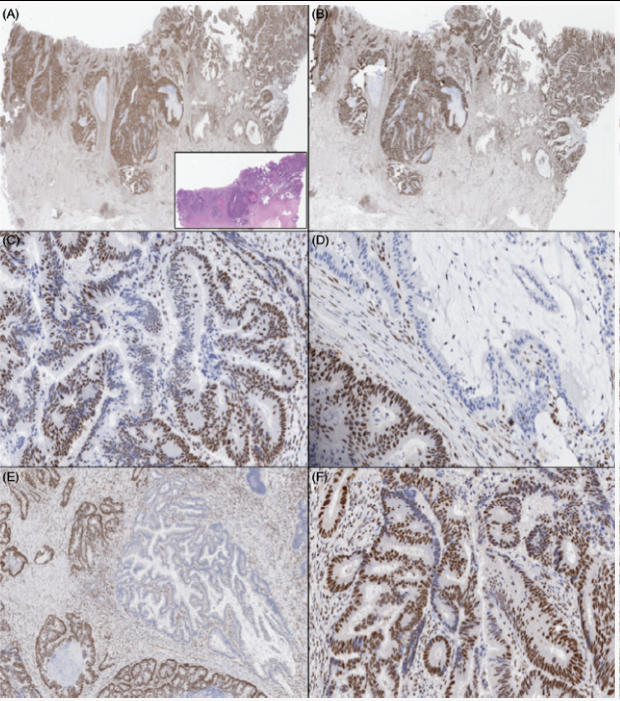
图1
案例 1(H&E ,A)显示完整的 MSH2(A)和 MSH6(B),具有 MLH1 的异质染色(在D) 和 PMS2 在 (C)、(E) 和腺内缺失 (F)。
病例2显示MLH1完全缺失,PMS2染色不均匀(图2);病例3 MLH1染色不均匀;病例4 MLH1和PMS2完全缺失,MSH6染色不均匀(图3)。
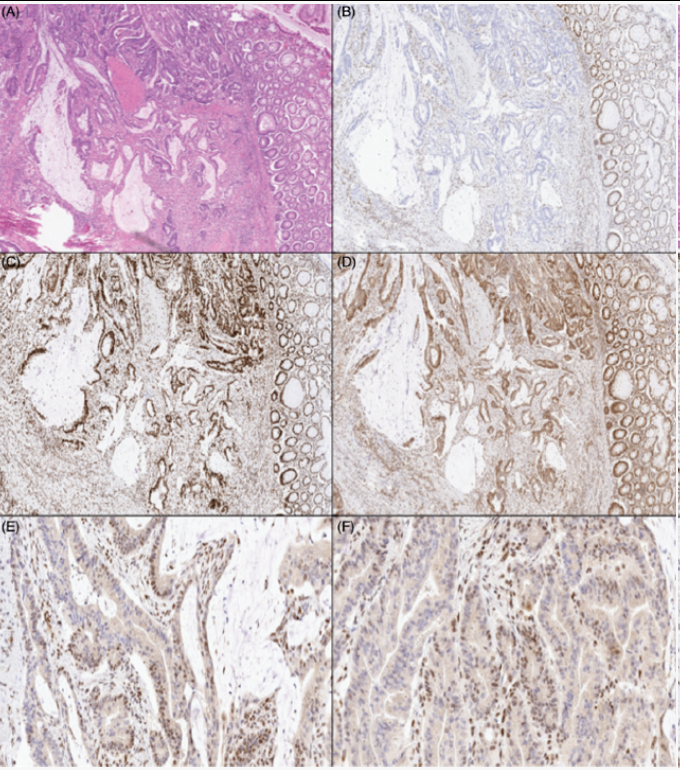
图1
案例 2(H&E,A)显示 MLH1 完全丧失(B),保留 MSH2(C)和保留 MSH6(D),具有异质染色PMS2腺内 (E) 和区域缺失 (F)。
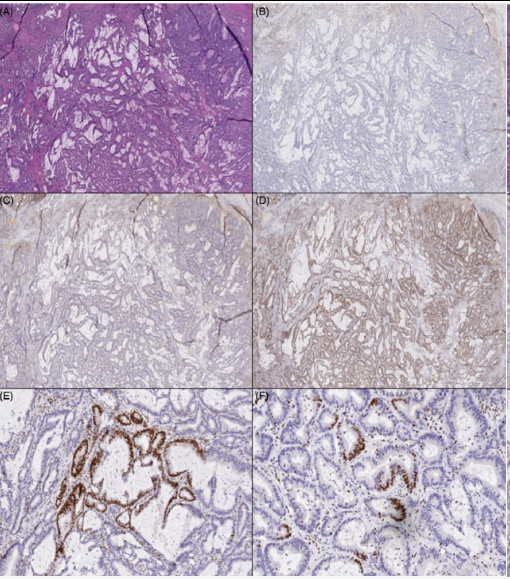
图3
病例 4(H&E, A)显示完整的 MLH1(B)、PMS2(C)和 MSH2(D),MSH6 的异质染色(E 和 F 显示区域和腺内损失)
病例5的MMR IHC表现为:胰腺癌MMR蛋白全部保留;胃癌MLH1和PMS2蛋白缺失,MSH2和MSH6蛋白保留(如图4)。
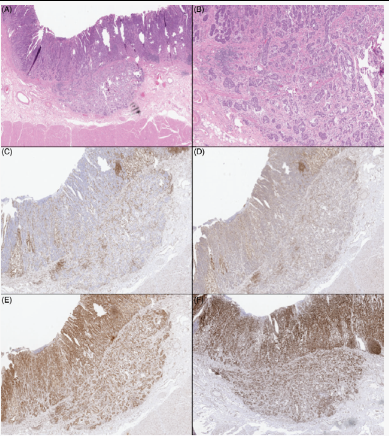
图4
案例 5:胃浸润性腺癌(H&E,A 和 B)显示 MLH1 (C) 和 PMS2 (D) 完全丧失和保留MSH2 (E) 和 MSH6 (F)。
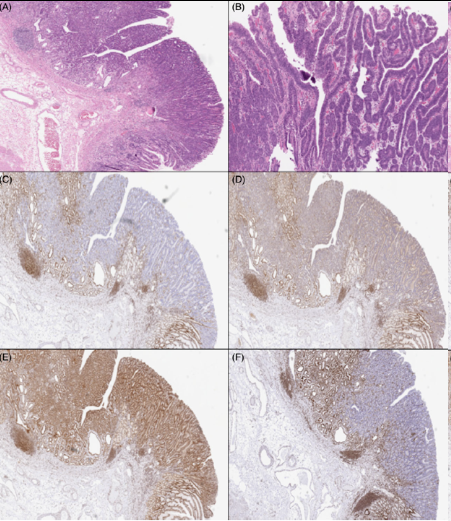
图5
病例5:胃发育不良(H&E、A和B)显示MLH1(C)、PMS2(D)和MSH6(F)完全丧失,MSH2(E)保留。
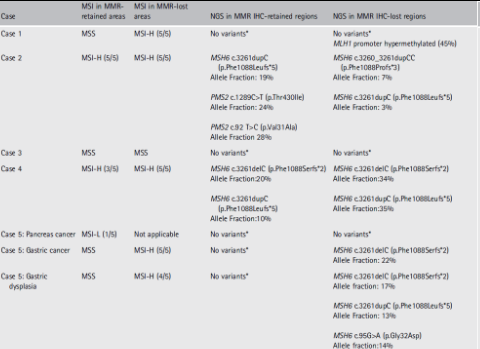
(3)MSI检测分析结果
MSI检测结果如表4所示。在病例1 (MLH1和PMS2的异质性MMR IHC)中,IHC保留区域的癌细胞为微卫星稳定(MSS),而IHC缺失区域为MSI-H。
病例2和病例4(PMS2和MSH6分别为异质性MMR-IHC)在IHC保留区和缺失区均为MSI-H,病例3(MLH1为异质性MMR-IHC)在IHC保留区和缺失区均为MSS。
病5例中,胰腺导管腺癌为MSI-L,MMR-IHC保留区为MSS,MMR缺失区为MSI-H,浸润性胃腺癌和胃增生异常灶为MSS,MMR-IHC保留区为MSI-H,MMR-IHC保留区为MSI-H,MMR缺失区为MSI-H。
表4 :FFPE 肿瘤组织中 MLH1、PMS2、MSH2 和 MSH6 基因的 MSI 状态和 NGS 分析以及 MLH1 甲基化结果
(4)NGS验证
表4概述了MLH1、PMS2、MSH2、MSH6和MLH1启动子甲基化分析的结果。NGS在五例病例的正常组织中未发现任何Lynch综合征相关的种系变异。
病例1中,在肿瘤中未检测到变体(异质性MLH1和PMS2蛋白染色;在MLH1免疫组化染色丢失的区域发现MLH1启动子高甲基化)。
在病例2中,肿瘤区域存在MSH6变体和两个PMS2错义变体存在PMS2表达,表现出MSI-H。在PMS2表达缺失的区域(也是MSI-H),同时存在两种MSH6形式。此外,MLPA分析未检测到PMS2基因的外显子del或dup。
在病例3中,MMR蛋白保留病灶和丢失病灶的MLH1启动子甲基化分析均正常。
在案例4中,在IHC阳性和IHC阴性肿瘤区域(异质性MSH6 IHC染色,两个区域均为MSI-H)都存在2种MSH6MSH6突变。
在病例5中,胃腺癌和胃异型增生中均存在相同的MSH6,但在表面异型增生(均为MSI-H)中也存在额外的MSH6突变。在胰腺浸润性导管腺癌(MSI-L)中未检测到MSH6突变。
(5)Sanger测序
Sanger测序证实病例2、4和5中存在MSH6变体,如图6所示。
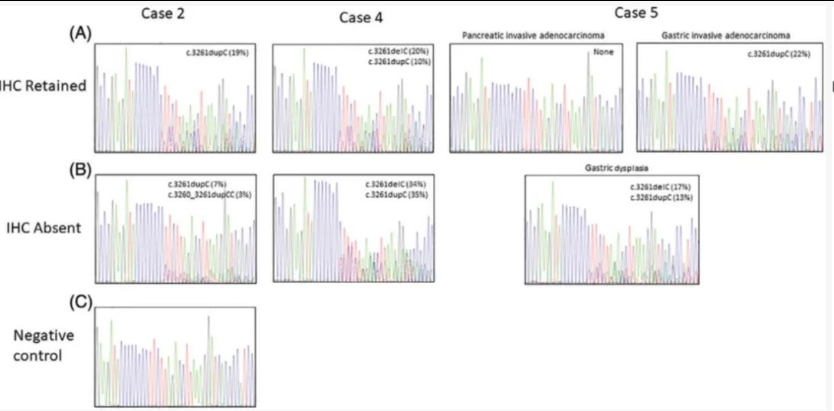
图6
病例 2、4 和 5 在 MSH6 中发现的5号外显子突变的 Sanger 测序电泳图。变体等位基因频率来自NGS 结果显示在每个案例的右上角。(A) 免疫组化保留区域的测序结果。(B) 免疫组织化学染色缺失区域的测序结果。(C) 正常 FFPE 控制不显示任何突变
03
讨 论
MMR缺乏表面上通过3种主要机制发生:
(1)MMR基因的体细胞高甲基化,最常见的是MMH-1;
(2) 一种遗传的MMR基因突变,以Lynch综合征为代表;
(3)染色体双体细胞突变。
结直肠癌中MSI状态的鉴定具有重要的临床意义,因为它有助于识别有Lynch syndrome风险的患者,并为患者提供预后和治疗信息。与MSS癌症患者相比,患有MSI-H的结直肠癌患者的预后有所改善。
肿瘤表现出异质性染色区域(MMR IHC 染色缺失/混合/强烈和弥漫性保留 MMR 蛋白的区域)不应被视为MMR IHC 完整/保留的病例或人工误差。尤其是 MSH6在肿瘤中经常发生异质性,但是如果 MSH2 蛋白是完整的(并且没有观察到异质性),那么林奇综合征是极不可能,这些病例应通过进一步进行分子分析,包括 MSI 和及测序。
04
相 关 产 品
产 品 优 势
Promega 的 MSI 技术是全球领先的"金标准"级 MSI 检测技术,也是全球第一个商品化的 MSI 检测系统。Promega MSI 技术已经 在临床研究中广泛使用了 15 年以上,并被 200 多篇学术论文引用。比 NGS 相比 , Promega MSI 技术更简单 , 成本更低,速度 更快,是可负担的标准化方法,与 IHC-MMR 检测相结合,可将灵敏度和特异性提高到近 100%。2021 年,Promega 的 MSI Analysis System 先后获得 CE-IVD 认证,美国 FDA 认证。同时,Promega 的 MSI检测产品目前正在中国进行国家药品监督管理局(NMPA)创新医疗器械特别审批认定的审核,即将作为体外诊断试剂(IVD) 上市。Promega 的 MSI 检测产品采用了 5 个单态单核苷酸重复微卫星位点设计,这也是美国国家癌症研究所 (NCI) 认可的设计。我 们采用了一组对检测 MSI 状态更敏感而特异的位点,从而得到更精准的结果,进而帮助医生对癌症患者评估出最佳治疗选择, 包括辅助诊断那些有望受益于免疫抑制剂治疗的患者。
Promega可提供从样本制备到MSI检测的完整解决方案。
Promega已与默沙东,Incyte及Henlius公司达成战略合作,共同开发MSI检测系统将作为其药物的伴随诊断试剂用于临床指导用药。
产 品 信 息
产品介绍请点击下表中产品名称
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
MD1641 |
100 rxns |
更多产品信息请咨询Promega


