细胞转染是指利用各种物理、化学、生物学方法,将外源分子(DNA、RNA 、mRNA等)导入真核细胞内,来改变细胞的特性,从而达到改造细胞的目的,它是实现细胞基因功能和蛋白质表达研究的重要工具。
根据导入的外源分子存在于宿主细胞的时间长短,细胞转染可以分为瞬转和稳转。根据转染方式又可以分为:物理转染法、化学转染法及生物转染法。
物理转染法
电穿孔法、显微注射法、基因枪法
化学转染法
磷酸钙共沉淀法、阳离子聚合物法、阳离子脂质体法
生物转染法
病毒介导法
对于了解或做过细胞转染实验的研究人员,想必上述方法大家都是非常熟悉的,我们也总结了这些方法的原理以及优缺点比较(表1),帮助大家找到适合自己实验的细胞转染方法。
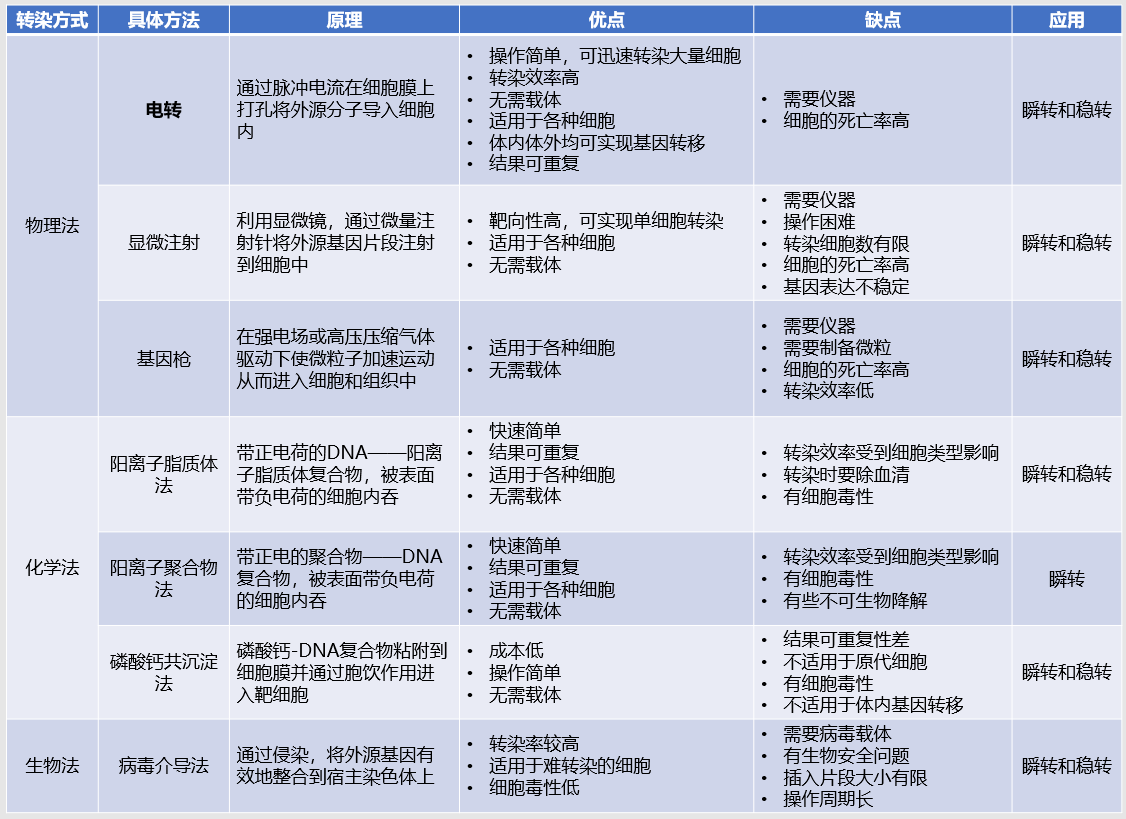
表1:三种转染方式的原理、优缺点和应用
通过各种转染方法的比较,我们发现电穿孔法,也就是电转,无论是在操作方法、适用范围以及转染效率等方面,都有着很大的优势。而现实亦是如此,由于电转的高效、低内毒、操作简单,并且可以瞬时和稳定地表达外源基因,因此常常用于科研领域的新药开发、癌症研究、免疫学研究等。
传统的电转实验操作流程,一般先利用电转缓冲液重悬细胞,然后对含有核酸、缓冲液、细胞的混合物给予合适的电脉冲,电脉冲会在细胞膜上形成电势差,从而诱导产生暂时的孔使核酸进入细胞,最后将细胞返回到生长培养基中,使其慢慢恢复,检测基因表达或沉默情况。在传统电转实验中,细胞死亡率高,并且原代细胞或干细胞的转染效率较低。考虑到传统电转的弊端,于是科研人员致力于开发更高效的电转技术,电转仪就在这时候横空出世了,目前市面上主流使用的就是Nucleofector™电转仪。
1998年,市场上第一个有效的、非病毒介导的Nucleofector™ 技术开发成功,可高效转染传统方法难以转染的原代细胞、干细胞、神经元和细胞系,为疾病研究治疗如基因治疗、免疫治疗和干细胞生成开发带来了新的机遇。Nucleofector™技术是Lonza公司的专利创新技术,利用电击在细胞膜上开个小孔,综合各种特定细胞转染程序与转染液的作用,核酸底物不仅可以进入细胞质,还可直接通过核膜进入细胞核。相较于传统电转技术,Nucleofector™技术的细胞转染率可达99%,且实现转染不依赖于细胞的分裂。
看到这里,想必大家都对Nucleofector™技术感到很好奇了,甚至有很多小伙伴表示已经使用过Nucleofector™电转仪了,那么接下来我们就来详细了解一下Nucleofector™技术吧~
Nucleofector™电转仪的组成
Nucleofector™电转仪由Nucleofector™仪器、细胞转染试剂盒和数据库组成。
01
Nucleofector™仪器
内置针对每种细胞优化好的转染参数。
02
试剂盒
试剂盒是包含有转染溶液,添加剂,专用电极杯,吸管,pmaxGFP™阳性质粒。
03
数据库与操作手册
在Lonza的数据库中提供了600种以上细胞的转染数据和操作手册,包括细胞来源、传代、生长条件,培养基以及转染后培养等细节技巧。

图1:Nucleofector™电转仪组成
Nucleofector™电转仪的优势
❖
质粒DNA的转染效率高达90%以上,单核苷酸如siRNA可以达到99%;
❖
良好保存转染细胞的生理状态和活性;
❖
转染后很快就可以分析转染效果;
❖
使用方便,已有超过650种细胞的转染实验方案;
❖
可转染多种底物,包括DNA、mRNA、miRNA、siRNA、肽段或蛋白;
❖
可处理难转染细胞的转染,包括原代细胞、干细胞和神经元等,另可在贴壁状态下转染;
❖
文献引用量高达8000+篇;
❖
使用一次性无菌Nucleocuvette™容器,降低交叉污染的风险;
❖
不同的Nucleofector™平台具有灵活的扩展功能,设备平台之间的条件可轻松转移。
实验操作步骤
01
收获目的细胞
按照转染需要的细胞量进行计数,如20 µl电转体系可转1x104-1x106个细胞,100 µl电转体系可转1x105-1x107个细胞;
02
混匀
低速离心,尽量吸去细胞上清,用电转Buffer重悬细胞,加入转染杯,加入准备好的质粒DNA,轻轻混匀,避免产生气泡;
03
电转
将转染杯放入转染仪,按键选择相应程序,按"start"键开始转染,等待指示图标显示绿色“+”号,即可完成实验;
04
培养
吸去电转Buffer,加入预热好的培养基,将细胞转移至培养皿中继续培养。若转染的质粒为试剂盒内的阳性对照质粒,一般在实验结束后7-8h内可在荧光显微镜下观察到实验结果。
来源于优宁维药物研发官网

