在细胞株开发 (CLD) 中,从细胞培养方法的优化和标准化到细胞健康监测,都依赖于细胞计数和活力测定,并贯穿整个 CLD 包括单细胞分离、克隆选择、扩增和随后的震荡培养 (Thunyaporn, Doh and Lee, 2021) 。
目前自动化和半自动化细胞计数器使用阈值算法对染色后的细胞图像进行分析,从而减少误差并节省时间 (Fagète, Steimer and Girod, 2019) 。然而,这可能需要一定程度上手动校准例如仪器校准或图像检测时的的阈值设定,增加了结果的不稳定性。此外,很多细胞计数仪还存在通量不够且数据管理效率低的劣势。
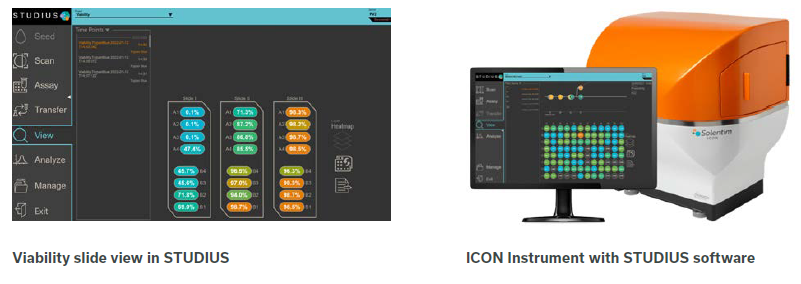
ICON 的活细胞计数原理是基于人工智能的神经网络算法,计算机通过对染色细胞形态例如圆度、大小、平整度等参数的充分学习,进行计数或者活细胞与死细胞的判定。快速、准确,避免了人为因素所导致的结果偏差。此外,样品用量少 (20 μL) ,一次可以检测多达 24 个样品,仅需 4 分钟,使其成为静态和悬浮培养板的理想选择。此外,我们从 CLD 的流程及实验人员的实际需求出发将 IgG 滴度测定功能整合进 ICON,轻松实现克隆产率结果的快速获取。
本篇重点对 ICON 活细胞计数及活率测定功能进行准确性的验证,并与市面上同类知名产品进行比较,结果显示,ICON 细胞识别算法准确,重复检测样品时结果变异较低,最终提高了结果准确度,并节省了时间,使其成为高通量 CLD 工作流程的理想选择。
实验材料
我们使用 CLD 中常见的细胞类型 CHO 和 HEK 作为实验材料,并从静态及摇瓶培养阶段分别取样,以涵盖不同培养阶段的检测情景。具体材料为:
•
在 CD OptiCHO (Gibco 12681029) + 8mM GlutaMAX (Gibco35050061) 中悬浮培养的 CHO-S (Gibco R800-07)
•
在 Expi 表达培养基 (Gibco A1435102) 悬浮培养的Expi293F (Gibco A14527)
•
在 DMEM High Glucose (Sigma D5796) + 10% Fetal Bovine Serum (FBS) (Gibco 10270106) 贴壁培养的293T (ECACC 12022001)
•
1x Phosphate Buffered Saline (PBS) (Gibco 10010023)
•
0.4% Trypan Blue (Gibco 11538886) (filtered and diluted with 1x PBS to produce a 0.125% solution for ICON)
•
ICON 细胞计数玻片 (Advanced Instruments RS-3010)
ICON Network 验证
首先,我们对神经网络的性能进行验证,使用人工标记活/死细胞的台盼蓝染色 CHO-S、Expi293F 和 293T 细胞图像(每株 27 张,共约 23000 个)作为数据集进行训练,此外每个细胞株的另外 16 张被标记的图像(共约 16,500 个染色细胞),作为 ground truth(即通过直接观察知道是正确的)。我们通过两种评价指标即:细胞计数的准确性和细胞识别的有效性(由平均精确度的平均 mAP 给出),来评估神经网络的性能。
其中,细胞计数精度计算为活细胞和死细胞的真实情况和计算机识别之间的平均百分比差异,其中正百分比差异表示计算机识别过度,负百分比差异表示识别不足。
而 mAP 则是一种通过精度和召回率来评估目标识别算法性能的指标。在这种情况下,“精度”指的是正确识别与所有识别的比例:
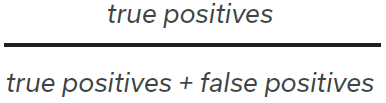
而“召回率”衡量的是正确识别与 ground truth 中所可识别的比例:

将精度值与召回值绘制成精度-召回曲线。然后,计算曲线下方活/死细胞的平均值结确定 mAP。由于精度和召回值总是在 0 和 1 之间,mAP 值也会在这个范围内,其中接近1的值表示网络具有高效的细胞识别能力。
下面我来看看 ICON 的细胞识别算法的准确性。
在对三类细胞类型的识别结果中,细胞计数精度在 ±1-7%。以 CHO-S 的差异值最小即 ±1-3.5%(图1)。
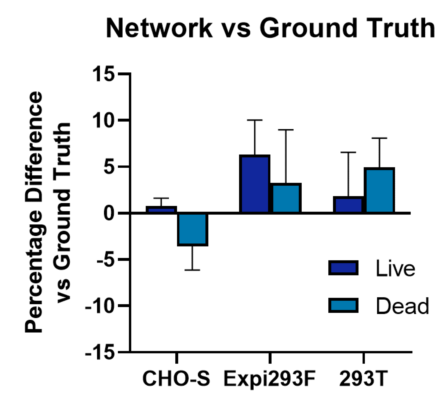
图1:计算机network和ground truth细胞计数之间的平均百分比差异。
图2 展示了所检测的三类细胞株的 mAP 值,在 0.85 到 0.90 之间(图2),即 ICON 的细胞识别算法模型在细胞活率检测上非常优异。
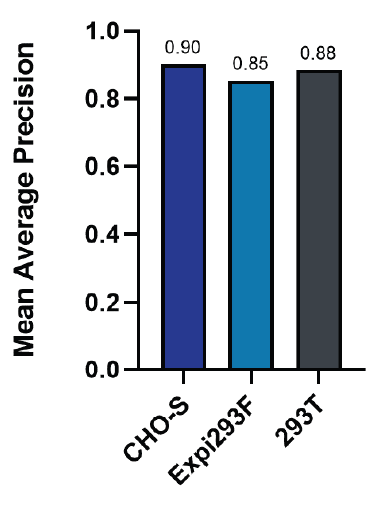
图2: 各细胞株对活细胞及死细胞识别得平均精确度得平均值。
来源于优宁维药物研发官网

