VHL蛋白(pVHL)通过调节HIF1α和Akt等蛋白底物的降解或激活而发挥肿瘤抑制作用。本文中,作者揭示了细胞周期素依赖性激酶1(CDK1)和肽基脯氨酸顺反异构酶1(PIN1)作为pVHL的调节因子,在三阴性乳腺癌症(TNBC)在内的多种野生型VHL的癌症中调节pVHL的稳定性及促进肿瘤进展的分子机制,并探索它们在治疗包括TNBC在内的野生型VHL癌症中的治疗潜力。
结 果
01
PIN1作为pVHL新型调节因子的鉴定
作者通过对cBioPortal癌症基因组数据库中收集的乳腺癌中的VHL改变进行分析发现,VHL基因在乳腺癌症中主要是野生型。然而,pVHL在TNBC组织中的表达显著低于正常乳腺组织,证实了pVHL在TNBC中的抑制作用(图1A)。且VHL的过度表达显著降低了MDA-MB-231细胞以及对顺铂和紫杉醇敏感的细胞的增殖、迁移和侵袭能力,而VHL的敲除显著显示出相反的效果(图1B–G)。为了鉴定TNBC中pVHL的调节因子,作者使用稳定表达FLAG-VHL的MDA-MB-231细胞进行串联亲和纯化和质谱分析,确定了肽基脯氨酰顺反异构酶NIMA相互作用1(PIN1)为潜在的pVHL相互作用蛋白(图1H-J)。
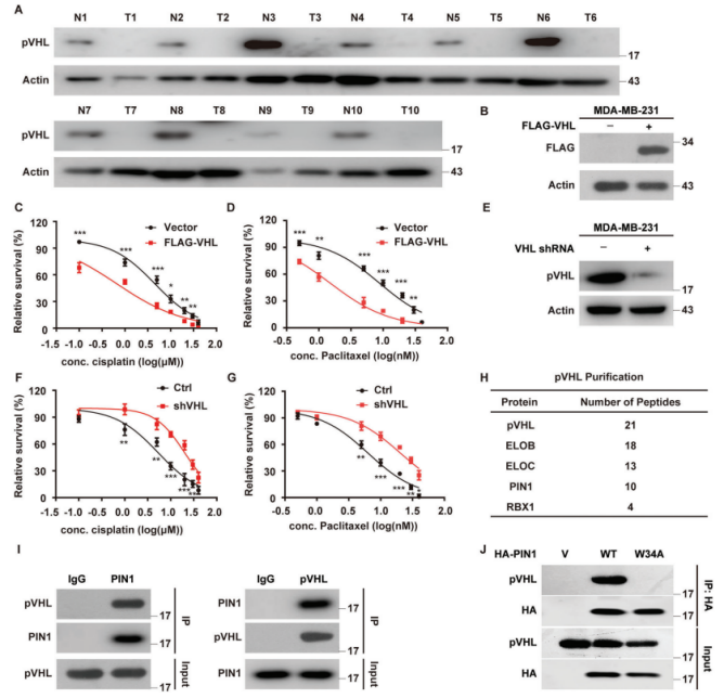
图1
02
PIN1调节pVHL的泛素化和降解
作者进一步研究PIN1在pVHL调节中的作用发现,在MDA-MB-231和BT-549中,PIN1的敲除和ATRA处理增加了MDA-MB-231和BT-549细胞的pVHL的蛋白质水平,但均不处于转录水平(图2A-D)。此外,通过基因消融或药物抑制靶向PIN1可以显著稳定TNBC中的pVHL(图2E,F)。为了验证PIN1是否会通过影响pVHL泛素化以破坏其稳定,作者进行了泛素化测定发现,在PIN1缺乏和ATRA处理的细胞中观察到多泛素化的pVHL的显著降低。单独敲除PIN1或WSB1降低了pVHL的泛素化水平,而PIN1和WSB1的组合敲除并没有进一步降低,这表明PIN1可能以依赖WSB1的方式调节pVHL泛素化。PIN1可以促进WSB1-pVHL的相互作用,从而增加TNBC中pVHL的泛素化和蛋白酶体依赖性降解(图2H-J)。
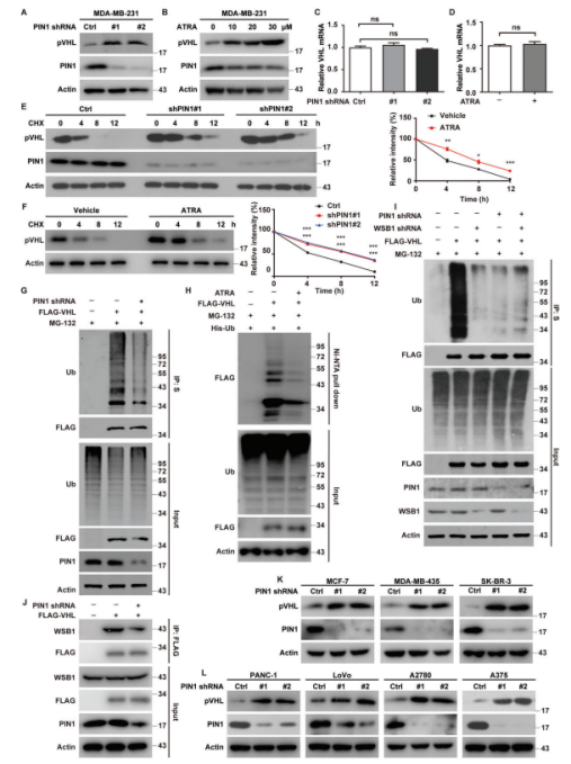
图2
03
PIN1通过破坏pVHL的稳定性促进肿瘤进展
接下来,作者通过研究PIN1在TNBC中的促肿瘤功能是否由pVHL介导发现,MDA-MB-231和BT-549细胞中PIN1的缺失显著增加了pVHL水平,同时显著降低了HIF1α和Akt磷酸化水平(图3A-D)。PIN1会破坏TNBC中pVHL的稳定性,从而激活其下游信号通路,如HIF1α和Akt。PIN1的减少在体外显著减少了MDA-MB-231和BT-549的细胞增殖、迁移和侵袭,而VHL的减少则显著恢复了这一点。当用ATRA处理细胞时,观察到类似的结果(图3E、F)。此外,ATRA的治疗显著增加了细胞对顺铂和紫杉醇的敏感性,而VHL的耗竭可以挽救这种效应(图3G,H)。异种移植试验的结果表明,ATRA抑制肿瘤生长并增加对顺铂的敏感性,这在很大程度上被VHL的减少所消除(图3I、J)。这些结果表明,PIN1在体外和体内至少部分通过影响pVHL的稳定性来促进TNBC的肿瘤进展。
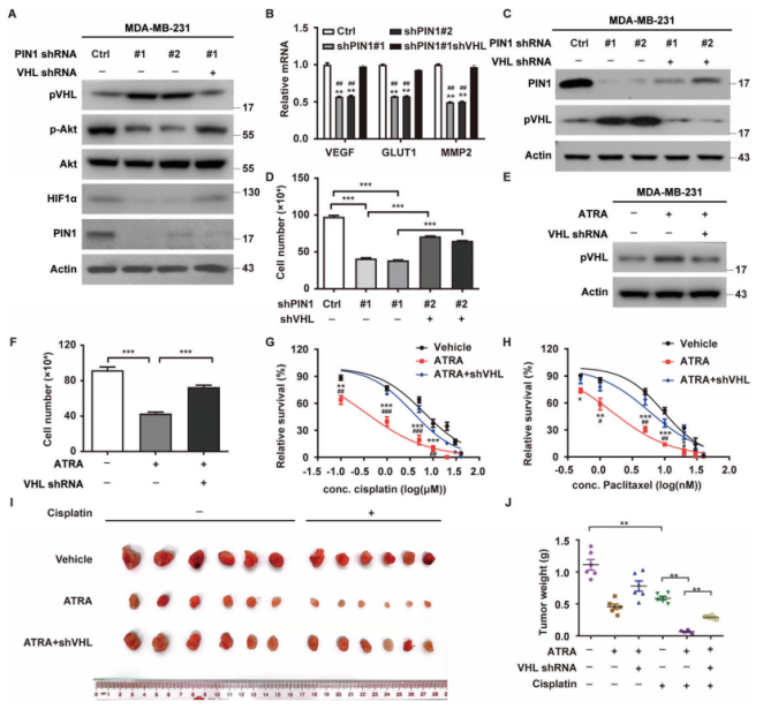
图3
04
pVHL在Ser80的磷酸化促进其泛素化和降解
作者通过使用CDK底物抗体观察了脯氨酸对FLAG-VHL的磷酸化作用发现,pVHL-PIN1的作用需要pVHL在Ser80-Pro81基序的磷酸化(图4A-D)。作者研究了Ser80对pVHL泛素化和降解的影响发现,这种磷酸化对于PIN1使pVHL不稳定至关重要(图4E-H)。作者进一步研究PIN1对pVHL抑制作用的影响是否取决于这种磷酸化,结果表明pVHL在Ser80的磷酸化对于通过破坏pVHL的稳定来促进肿瘤进展至关重要(图4I-L)。
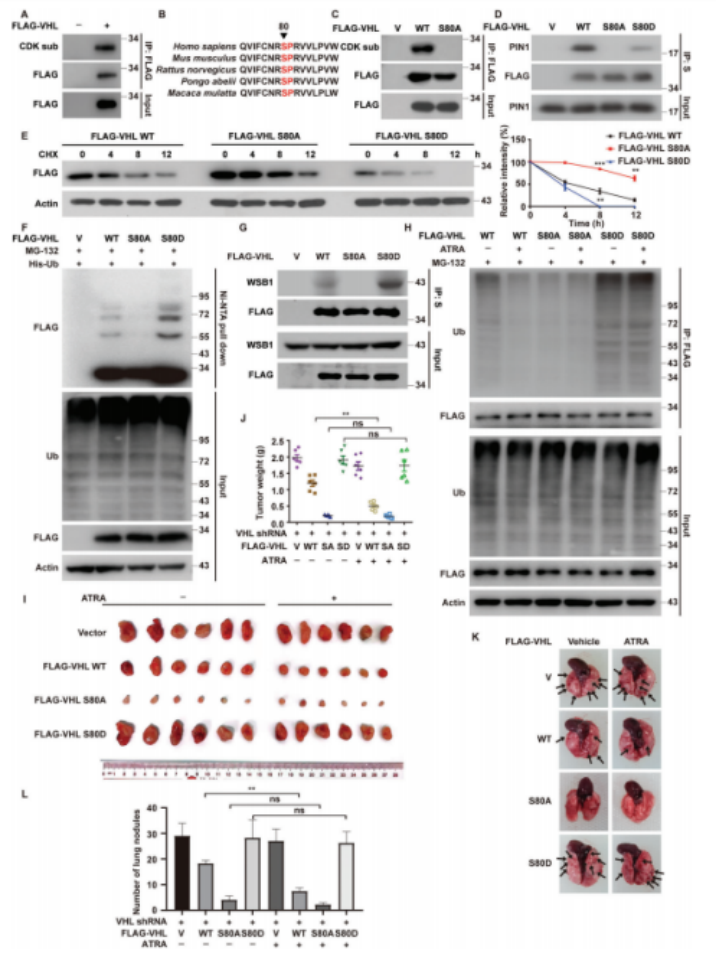
图4
05
CDK1在Ser80处结合并磷酸化pVHL
为了鉴定在Ser80磷酸化pVHL的特异性激酶,作者使用脯氨酸定向激酶的不同抑制剂来治疗MDA-MB-231细胞,结果发现CDK1(Carna Biosciences)抑制剂RO-3306显著增加了pVHL水平,而CDK2的减少对其没有影响,表明pVHL和CDK1之间的直接相互作用(图5A-C)。作者评估了CDK1对pVHL磷酸化的影响发现,减少CDK1或药理学抑制,pVHL的磷酸化显著降低。活性CDK1可以在体外磷酸化GST-pVHL-WT,但不能磷酸化S80A突变体(图5D,F)。RO-3306对CDK1的抑制显著降低了PIN1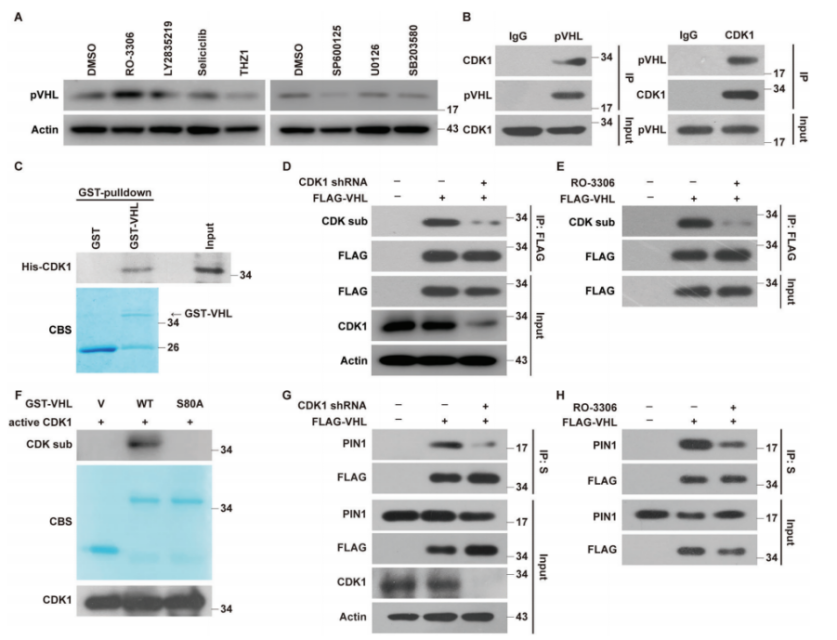 pVHL之间的相互作用(图5G,H)。这些发现证明了CDK1磷酸化pVHL的Ser80。
pVHL之间的相互作用(图5G,H)。这些发现证明了CDK1磷酸化pVHL的Ser80。
图5
06
CDK1磷酸化pVHL并促进其泛素化和降解
作者进一步研究发现,CDK1的缺失或抑制可以增加TNBC细胞中pVHL的蛋白水平(图6A-D),而不会影响其mRNA水平。此外,pVHL在用RO-3306处理的细胞中更稳定(图6E)。接下来作者研究CDK1对pVHL泛素化的影响。在CDK1缺陷细胞或用RO-3306处理的细胞中观察到多泛素化的pVHL的显著降低,这可能是由pVHL和WSB1之间的相互作用降低引起的。RO-3306的处理显著降低了多泛素化的VHL WT,但不影响S80A或S80D的泛素化。CDK1的缺失显著增加了其他类型癌症细胞中的pVHL水平,包括黑色素瘤、胰腺癌、结直肠癌、卵巢癌症和其他类型的人类乳腺癌(图6F-L)。总之,CDK1可以磷酸化和破坏多种野生型VHL癌症中的pVHL的稳定性。
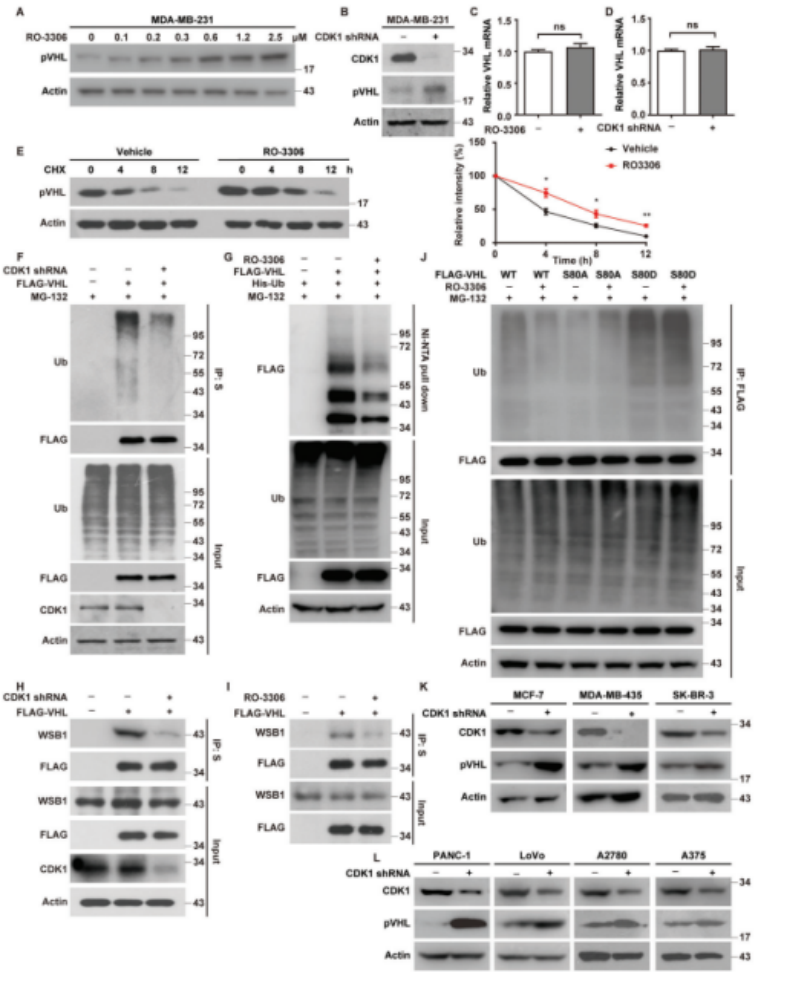
图6
07
CDK1通过破坏pVHL的稳定性促进肿瘤进展
作者研究了CDK1是否通过破坏pVHL的稳定而导致TNBC的恶性进展,结果发现CDK1通过破坏含有野生型VHL的癌症中pVHL的稳定性来促进肿瘤进展。通过进一步研究发现PIN1和CDK1协同破坏pVHL的稳定,从而促进TNBC的肿瘤进展。总之,该研究证明了PIN1/CDK1协同破坏pVHL稳定和促进肿瘤进展的新机制,因此靶向PIN1和CDK1可能是治疗TNBC和其他野生型VHL癌症的潜在治疗策略(图7)。
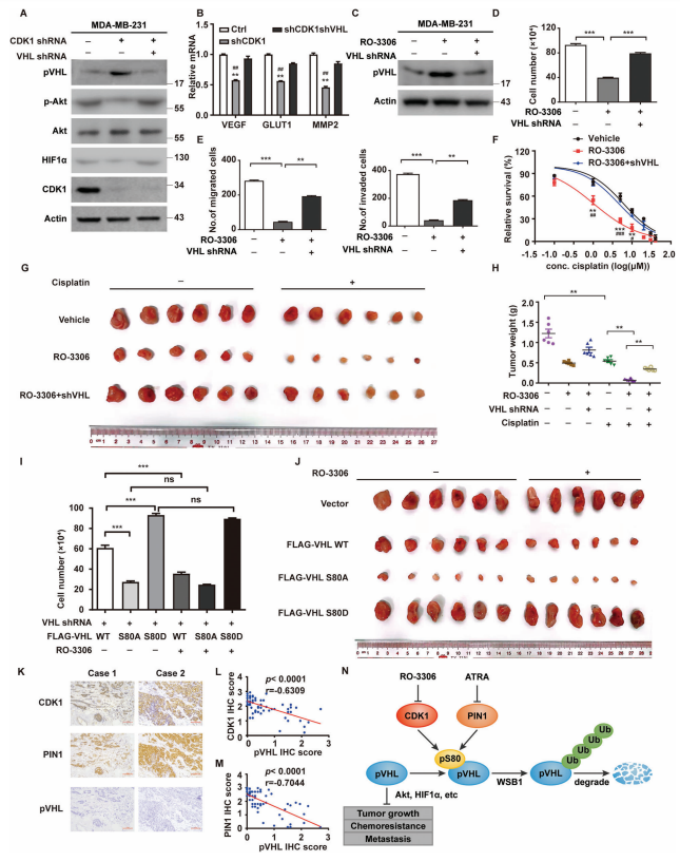
图7
参考文献:
Chen J, Li M, Liu Y, et al. PIN1 and CDK1 cooperatively govern pVHL stability and suppressive functions. Cell Death Differ. 2023 Apr;30(4):1082-1095. doi: 10.1038/s41418-023-01128-x.
来源于优宁维药物研发官网

