概括
本研究评估基于mRNA的多功能CAR-T细胞治疗对胶质母细胞瘤在体外和体内的治疗效果。通过对胶质母细胞瘤小鼠和细胞模型使用荧光分子断层扫描分析和高内涵成像分析,研究人员发现共表达促炎细胞因子IL12和IFNα2的NKG2D CAR-T细胞治疗是最有效的,并且拥有数量最多的活化态T细胞。本研究为未来的恶性脑肿瘤临床研究使用基于mRNA的多功能CAR-T细胞治疗提供了强有力的理论依据。
胶质母细胞瘤是最常见的成人恶性脑肿瘤类型,预后很差,确诊后只有10%的患者存活时间超过五年。胶质母细胞瘤患者的标准治疗手段是手术,随后放疗和化疗。不幸的是,经过这种治疗策略的病患很少痊愈,所以迫切需要发现更有效的治疗方法。
在血液癌的患者中,嵌合抗原受体 (CAR) T细胞疗法已经提供了有希望的临床效果,使研究人员探索该疗法在实体癌中的应用可能性。然而,CAR-T细胞针对胶质母细胞瘤的抗肿瘤活性迄今很少报道。这是由于以下几个因素:包括肿瘤免疫抑制微环境对CAR-T细胞活性的影响、肿瘤异质性带来的鉴定肿瘤特异性抗原的挑战,以及CAR-T细胞疗法的持久性有限。
为了克服这些挑战,多靶点CAR具有很大潜力。然而这些使用载体系统的方法具有一定的局限性,例如有限转基因能力、冗长的制造过程以及肿瘤外毒性的风险。研究人员正在通过探索基于mRNA的CAR-T策略来解决这些局限性,它为基于载体的系统提供了一种安全、快速且低成本的替代方案。
评估基于mRNA的
多功能CAR-T细胞的抗肿瘤活性
在最近的一项研究中,Meister等人开发了基于mRNA的多靶点CAR-T细胞,显示出极具希望的抗神经胶质瘤的体外和体内活性,此CAR-T细胞共表达NKG2D受体与促炎细胞因子IL12和IFNα2。NKG2D是一种激活型细胞表面受体,细胞致癌转化时,它的表达会被高度诱导,是极具潜力的CAR-T靶点。这项研究为未来使用基于mRNA的多功能CAR-T细胞治疗恶性脑肿瘤的临床研究提供了强有力的理论依据。
方法和结果
针对两种神经胶质瘤细胞系,GL-261或CT-2A,研究人员使用电穿孔的方法生产基于mRNA的鼠CAR-T细胞,所包含的mRNA可表达NKG2D CAR或/和两种促炎细胞因子(mIL12和mIFNα2)。CAR和细胞因子的共表达使两种细胞系的细胞裂解活性达到最高水平。
Meister及其同事建立荷瘤小鼠模型,使用静脉内及瘤内给药来确定基于mRNA的CAR-T细胞的抗肿瘤活性。该团队使用荧光分子断层扫描 (FMT) 成像检测IV给药后CAR-T细胞在肿瘤中的积累(Fig1)。
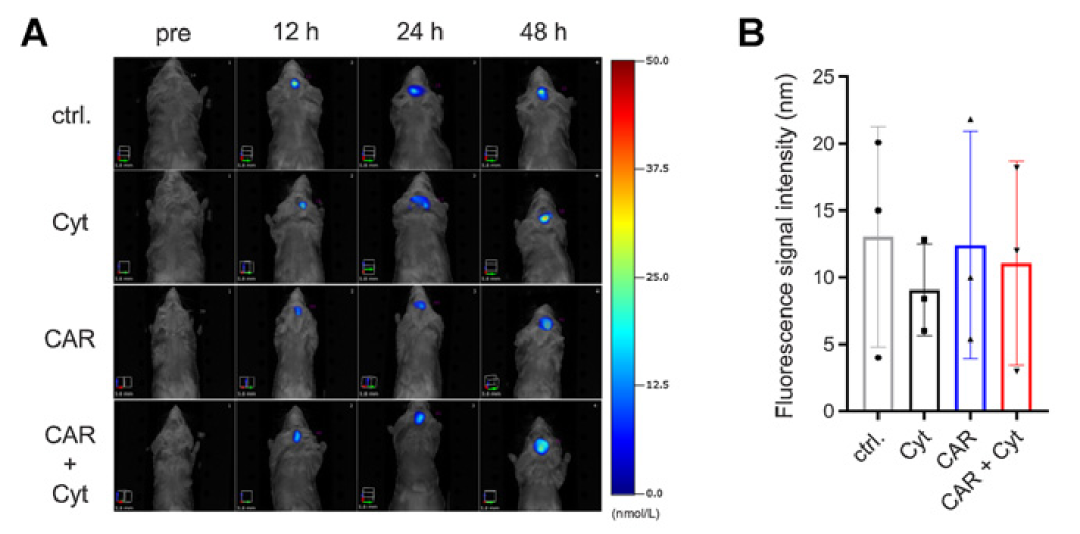
Fig1. 基于多功能mRNA的NKG2D CAR-T细胞在静脉注射和瘤内给药的原位免疫小鼠胶质瘤模型中具有很好的抗肿瘤活性。Ctrl:小鼠T细胞模拟电穿孔;Cyt:转染编码mIL12和mIFN a2的mRNA的小鼠T细胞, CAR:转染NKG2D CAR的小鼠T细胞 ,CAR+cyt:共表达mIL12和mIFN a2和NKG2D CAR的小鼠T细胞。随后用CellBrit790染料标记细胞,并于脑内接种GL-261细胞后第4、7、10、13天静脉注射5X 106个细胞。在第一次注射后12、24、48小时,用FMT检测肿瘤部位标记T细胞的荧光信号(图示蓝色光斑)。A显示每组1只代表性小鼠,B展示每组3只小鼠的定量结果。
值得注意的是,相对于只表达CAR或NKG2D的T细胞来说,IV注射共表达mIL12和mIFNα2的NKG2D CAR-T细胞的小鼠具有更高的存活率。瘤内给药可进一步改善共表达mIL12和mIFNα2的NKG2D CAR-T细胞的治疗效果。84%的GL-261胶质瘤小鼠在接受两次瘤内注射治疗后存活。
为了确定此方法的转化潜力,研究人员生成了外周血单核细胞衍生的mRNA修饰的T细胞,并使用Opera Phenix® 高内涵成像分析系统来评估它们的抗肿瘤活性。对胶质母细胞瘤患者的样本进行消化,接种到透明底的 PhenoPlate™ 384微孔板中,并与空白对照或mRNA修饰的CAR-T细胞共培养24小时(Fig2A)。细胞混合物含有神经胶质瘤细胞以及来自肿瘤微环境的细胞。细胞被固定,用BioLegend®抗体染色。接着使用Opera Phenix®高内涵筛选系统以确定工程化T细胞在单细胞水平的抗肿瘤活性。
分析显示癌细胞减少程度最大的实验组是共表达hIL12和 hIFNα2的NKG2D CAR-T细胞组。相反,只表达CAR或促炎细胞因子并没有造成神经胶质瘤细胞的数量减少。为确定特异性T细胞表型是否与抗神经胶质瘤活性增加有关,研究人员通过基于深度学习的形态学分析评估了T细胞的活化。在六个患者的样品中,T细胞共表达NKG2D CAR和hIL12和hIFNα2的实验组包含数量最多的激活态 T 细胞。其中,有四个病人样品明显高于单独的NKG2D CAR-T细胞组,表现更高的激活水平(Fig2)。
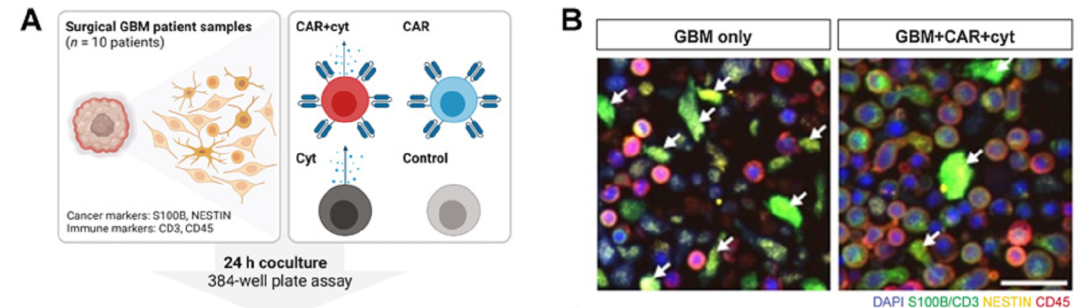
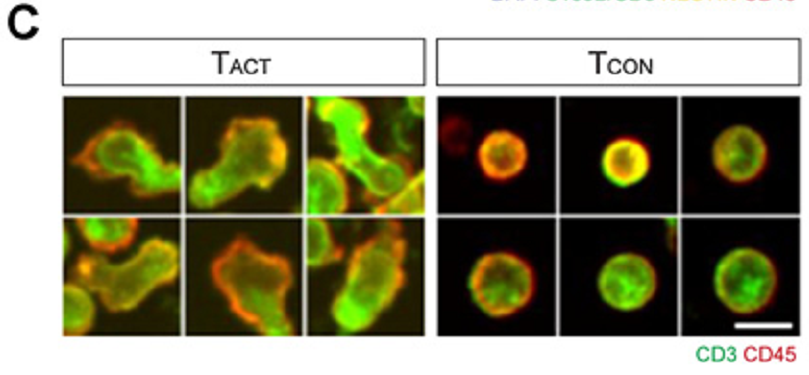
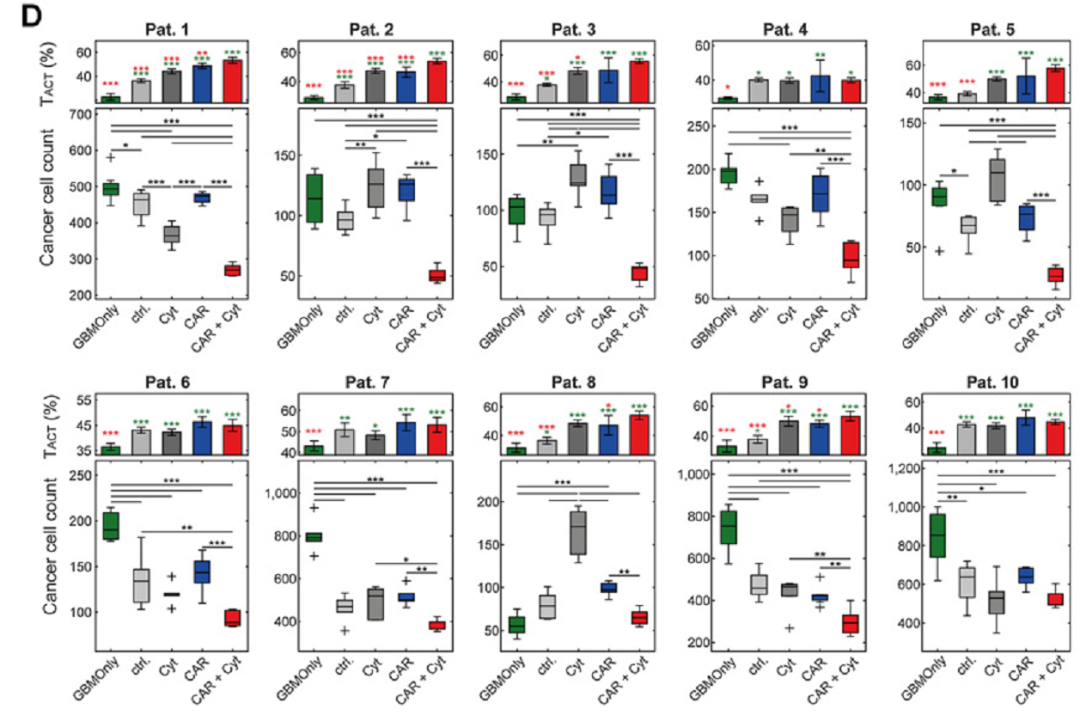
Fig2. 基于人mRNA的多功能CAR-T细胞表达IL12和ifna2在复杂胶质母细胞瘤患者样本中具有很好的抗肿瘤活性。A,胶质母细胞瘤(GBM)患者样本与不同mRNA修饰的T细胞体外共培养方案。手术患者胶质母细胞瘤样品(n¼10)与空白转染的T细胞(ctrl.)、表达hIL12-和hIFN a2的T细胞(Cyt)、hNKG2D CAR-T细胞(CAR),或共同表达hNKG2D CAR以及hIL12和hIFN a2的多功能CAR-T细胞(CAR+Cyt)共培养24小时。B,代表性免疫荧光图像:胶质母细胞瘤患者样本(患者1)中缺乏修饰的T细胞(左),存在共表达hIL12和hIFN a2的多功能CAR-T细胞(右)。白色箭头表示癌细胞。C,图示有代表性的单细胞形态,T细胞根据其形态分类为TNet激活态(TACT)或非激活态(TCON)。D,将10个胶质母细胞瘤患者样本与不同的修饰T细胞共培养,在单细胞水平进行分析,获得每个患者不同共培养组的胶质瘤细胞数量(下)和t细胞激活状态(上)。癌细胞数量以箱形图显示,T细胞采用活化形态(TACT%)的比例以条形图显示。
结论
CAR-T细胞疗法彻底改变了血液癌的治疗方法,但这种成功尚未实践于胶质母细胞瘤。限制其在实体癌疗效的因素包括肿瘤异质性,免疫抑制微环境,和CAR-T细胞持久性。基于mRNA的CAR-T细胞治疗是一种有前途的方法,可以克服这些挑战并促进创新CAR-T策略的临床转化。上述的研究--基于多功能mRNA的NKG2D CAR-T细胞共表达两种促炎细胞因子—已经将动物活体疗效成功转化到胶质母细胞瘤患者样本。该团队指出,基于mRNA的T细胞修饰活性短暂的特点,对控制非肿瘤毒性是有利的,但还需要长期检测。总之,他们认为此方法针对胶质母细胞瘤患者是一种有前途的治疗策略。
参考文献
1. Meister H, Look T, Roth P, Pascolo S, Sahin U, Lee S, et al. Multifunctional mRNA-based CAR-T cells display promising antitumor activity against glioblastoma. Clinical Cancer Research. 2022 Nov 1;28(21):4747–56.
来源于优宁维药物研发官网

