宿主细胞蛋白(HCP)分析是生物制药早期临床试验、下游工艺设计和质量控制的一个重要问题。使用市售的通用HCP测定法,还是花费大量资金开发特定的HCP测定法,往往不是一个容易的决定。理论上,通用的HCP测定方法应该适用于特定细胞系的所有HCP测定,而不受细胞系修饰、发酵条件和纯化工艺设计的影响。但在大多数情况下,一般的HCP测定法不能显示出所需的特异性和敏感性。增强型的CHO|360-HCP ELISA可能是目前使用的通用市售HCP测定法的有价值替代方法,因为它旨在覆盖更广泛的CHO-HCP谱。
CHO|360-HCP ELISA抗体和检测方法的开发
用模拟转染CHO K1和CHO S细胞的等量HCP免疫家兔和山羊制备多克隆HCP抗血清。我们使用不同制备的抗原:Total HCP或Fractionated HCP(Table 1)。每种HCP片段(低分子量、中分子量和高分子量)分别用于免疫。
采用优化的纯化策略获得抗总HCP的单特异性多克隆抗体。纯化前将不同HCP组分的抗血清合并。这就产生了四种不同的HCP检测方法(A型到D型),它们共同构建了增强型通用CHO|360-HCP ELISA试剂盒(见Table 1)。对于所有四种检测类型,检测下限(LOD):0.5-1 ng/mL;定量下限(LOQ):2-3 ng/mL;工作范围:2-100 ng/mL。
特异性和HCP回收率
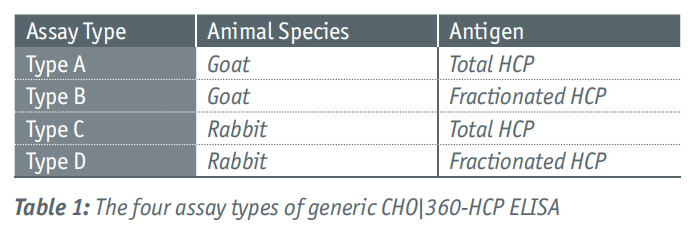
通过CHO-HCP标准品的二维凝胶电泳和对应的A -D型ELISA抗体的免疫印迹(Figure 1)确定了四种检测方法对抗原的高特异性。作为参考,将HCP的二维蛋白模式转移到硝化纤维素膜上并用胶体金染色(见Figure 2b)。

不同模拟HCP样品和工艺过程中HCP的测定
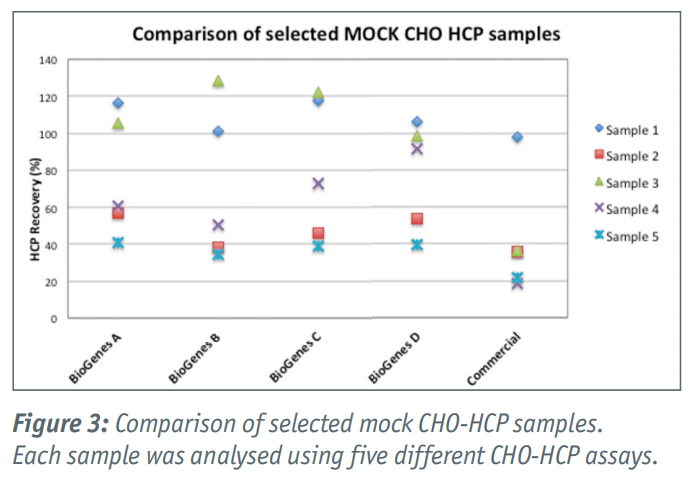
基于大量模拟CHO-HCP样本,CHO|360-HCP ELISA试剂盒已被广泛测试。所有样品均来源于CHO细胞的模拟发酵,与某些生物制剂的生产过程相对应。对于每个HCP样品,首先用Bradford法测定蛋白质量。此外,每个样品使用五种不同的CHO-HCP测定法进行分析:BioGenes通用CHO|360-HCP ELISA A-D型和常用的市售通用CHO-HCP试剂盒(Figure 3)。蛋白质回收率以样品确定的Bradford值的百分比计算。
每个样品的回收率在很大程度上取决于所使用的测定法(Figure 3)。Sample 4 (x)使用Type D型估计回收率>90%,Type A-C的回收率要低得多,市售其他试剂盒的回收率仅为20%。在大多数情况下,使用我们的四种通用CHOI360-HCP ELISA (A-D型)中的一种来估计最佳回收率。回收率高于100%是基于各自ELISA的overestimation。
结 论
根据上述数据,我们得出结论:没有一种通用的HCP检测方法适用于所有样品。使用CHOI360-HCP的四种ELISA (A -D型)和伴随的2-D分析,通过测试各自工艺的模拟CHO-HCP以及一些过程中的对照,可以确定最合适的抗体。这种“可行性测试”确实大大提高了大多数样品的HCP回收率。
来源于优宁维药物研发官网

