宿主蛋白(HCP)作为工艺过程相关杂质,其残留含量通常被认为是产品的关键质量属性(CQA)。生物制药过程中细胞培养会产生大量的HCP,生物制品尽管进行了多种方式的纯化,但依然会有不同程度的HCP残留。
HCP残留可能会影响产品的属性以及在生产和储存期间降解产品,甚至影响产品的免疫原性、生物活性和安全性。
各国药典及药品监督管理局均有相应指导文件,例如:
❖
美国FDA HCP残留量可接受的范围是1-100ng/ml
❖
现行版中国药典明确规定CHO细胞HCP含量小于0.01%
因此,HCP的表征和监控是生物制品工艺开发和生产中必须重视的一个考量因素。一般准则(EMA,FDA,中国药典)建议为药物审批提供特定检测方法的数据,其中ELISA仍然是金标准。
如何确保ELISA检测方法的稳定性?
德国著名的生物技术公司
BioGenes解决您的后顾之忧!
01
足够数量的抗体和标准品库存
为的就是确保在药物研发产品的整个生命周期内可提供所有试剂盒组分。而且,我们可签订提供长期交付ELISA试剂盒及相关组分的供应协议。
02
批间一致性
根据BioGenes的质量准则,通过对每个生产批次进行放行测试,确保一致的质量;包括检测组成性ELISA试剂盒参数,如反应性、标准曲线、标准样品和对照样品的精密度和准确度。
03
质量稳定性
每种类型的抗体都可以从备用的抗血清(储存在-20℃)中复制出来,质量稳定。通过大规模生产基本产品(捕获抗体、检测抗体、标准品)来确保长期稳定的质量。
BioGenes成立于1992年,总部位于德国柏林——德国制造,世界精工,品质过硬信得过!
BioGenes 已经开发出增强型的 CHO,E.coli,HEK293 HCP 分析方法,明显优于当前的其他商业化通用型 HCP ELISA 试剂盒。
根据 Biogenes 长期经验和数据分析得出结论,没有一种通用的 HCP 检测方法适用于所有样本。Biogenes 通过A~D 型四种不同试剂盒的组合,以及伴随的 2D 分析测试各个过程的模拟HCP以及多个过程控制样品(ICP)来确定,这种前期可行性测试可大大提高大多数样品的回收率。
为了证明这一点,我们基于大量模拟CHO HCP样品测试了CHO|360-HCP ELISA试剂盒(A至D)和市售通用CHO HCP测定。在大多数情况下,与其他商业试剂盒相比,使用四种CHO|360-HCP ELISAs试剂盒中的一种实现了最佳回收率(见下图)。
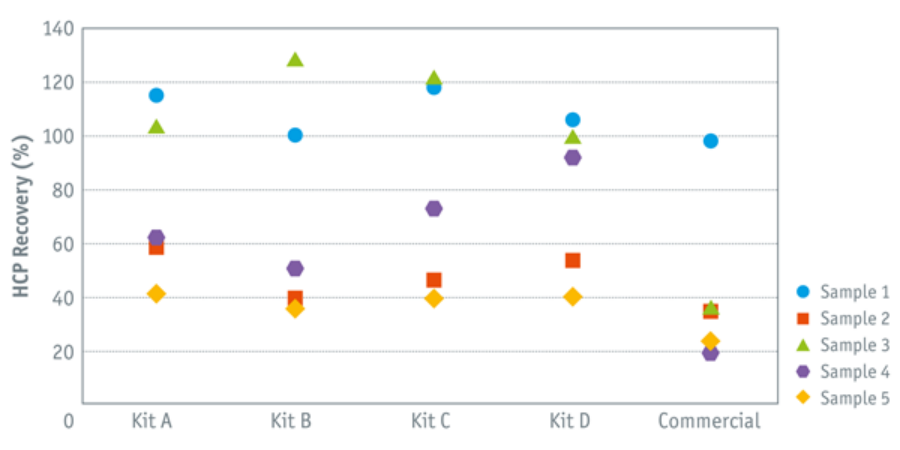
样品4:使用D型ELISA试剂盒估计回收率为>90%,而ELISA试剂盒A,B和C以及商业试剂盒的灵敏度较低,后者仅检测20%的宿主细胞蛋白
来源于优宁维药物研发官网

