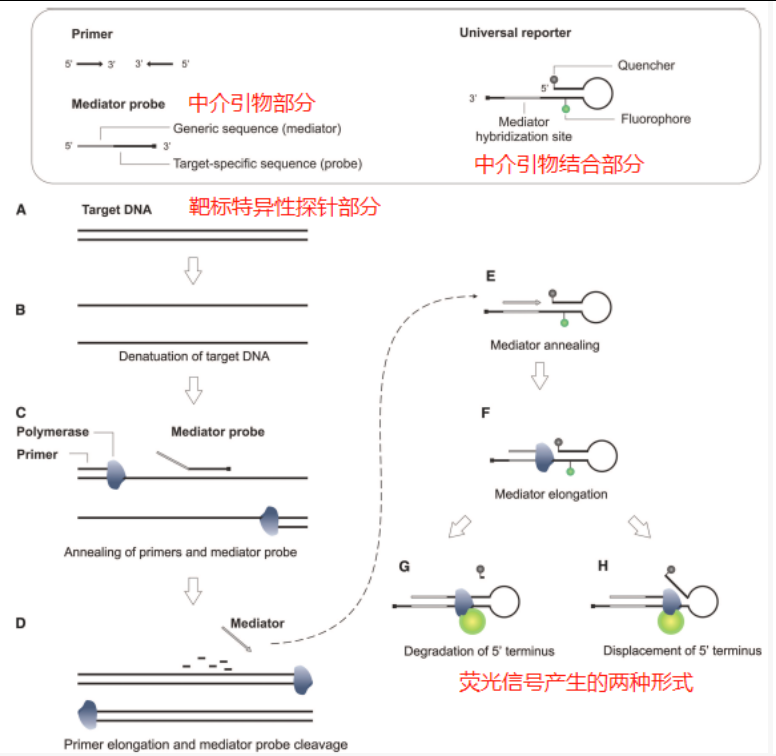
大多数已建立的qPCR扩增检测技术都涉及单个靶标的特异性荧光探针。当分析许多不同的靶标时,这些探针的合成会增加分析开发过程中的总成本。如果使用通用和特异性的引物结合进行扩增,有可能造成非特异性产物。因此,在使用保证特异性的基础上,使用中介探针可以解决这个问题[2]。
中介探针包括一个靶标特异性的探针部分和一个通用的中介引物部分,探针的3’末端需要进行封闭。在上下游引物参与延伸的前提下,探针结合靶标后,中介探针被聚合酶的5端核酸酶活性裂解。中介探针的断裂会释放中介引物,该引物继而启动通用的报告系统。通用报告系统包含两部分,分子信标部分和与中介引物结合的区域。分子信标部分包含一个标准的茎环,通常在5端标记淬灭基团,茎部的末端中间T碱基上标记荧光基团,当然荧光和淬灭基团的顺序可以颠倒。分子信标的3’末端伸出了一段序列,用于和中介引物进行结合,3’末端需要使用氨基或者C3 spacer进行封闭。中介引物会与通用报告系统中的中介引物结合区域发生互补后进行延伸。延伸后可以通过对分子信标的剪切完成淬灭基团和报告系统的分离,或者通过占据茎部的区域,将原本分子信标中淬灭基团的茎部替换下来,使荧光和淬灭基团彼此相互远离,两种办法都可以让荧光得到释放,荧光会在每个PCR循环中得到积累。
由于报告系统和中介引物使用的都是通用性的序列,可以合成不同的中介探针同时对多个靶标进行检测,而只合成一条报告系统。但这个报告系统也有着明显的缺点,就是同一通道的荧光信号可能来源于多个靶标,无法分辨信号的来源。而如果想要有区分性,那就得使用不同的通用中介引物和不同荧光通道的报告系统。这样就达不到降低成本的效果了。因此,需要建立一种在单荧光通道下实现多重靶标检测的办法。
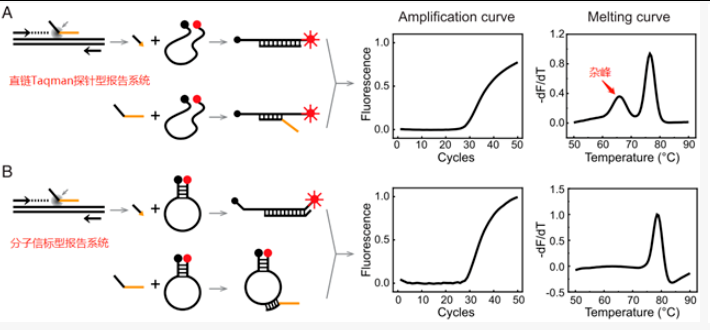
使用多重扩增探针熔解曲线法MMCA可以在单个荧光通道下同时对多个靶标进行检测[1],通过熔解曲线Tm值的不同来判定是哪个靶标发生了扩增。这种方法也可以应用于中间探针的报告系统中,在报告系统中设置多个与不同靶标来源的中介引物的结合位点来实现多重检测。传统的MMCA检测中,报告探针系统分为直链型的Taqman探针和分子信标两种形式。因此中介探针使用的报告系统也需要对这两种报告系统进行初步筛选。下图A是直链Taqman探针型报告系统,图B是分子信标型报告系统。两种报告系统都能获得正常的扩增曲线和目标溶解曲线峰,但直链Taqman探针型报告系统在主峰的左侧还能产生一个杂峰,这是因为分子信标具有更高的特异性,未发生酶切的中介探针不能改变分子信标中荧光和淬灭基团的距离,但是却能增加直链Taqman探针中间荧光和淬灭基团的距离(原始探针呈现无规则卷曲状)。很明显分子信标型报告系统降低了背景,更适合多重荧光定量检测[3]。
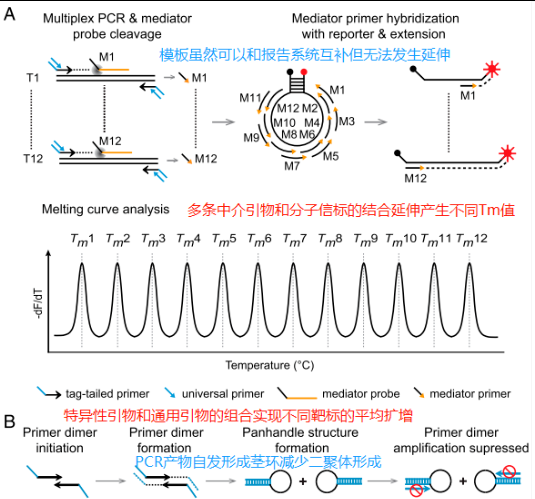
MeltArray是融合了MMCA和中介探针的方法,这里使用的报告系统不再是茎环+末端悬挂序列的结构,因为这种办法会导致茎环型分子信标部分被切割,会导致熔解曲线峰降低,不利于熔解曲线法检测。所以,报告系统采用了传统的分子信标结构,但是它的环部序列非常长,这样可以同时容纳多个中介引物与其结合。中介引物结合环部后进行延伸,通过形成双链的刚性结构打开茎环。延伸出的单链和茎环后续可以进行溶解曲线分析。不同的中介引物由于结合部分不同,延伸出来得到的单链长度不同,和报告系统进行溶解曲线分析,在56-91°C的宽范围内有间隔的产生了不同的Tm值,Tm的差值在3度左右。这里比较精妙的设计是将低Tm值的中介引物设置在茎环的3’末端,这样延伸出来的双链对茎环的“拉扯力”最大,最容易打开茎环结构,所需延伸的长度也最短。
在多重PCR扩增上,MeltArray也有其特殊的设计,首先使用带有5端标签的特异性引物进行前几轮扩增,由于加入的引物量不多,很快这种引物就被耗尽。之后标签对应的通用引物(大量)完成后续的PCR扩增过程,这样做的好处是保证不同的扩增产物的量比较均衡,从而让多个靶标都被检测到而没有遗漏[4]。另外为了靶标能有效率的被扩增,引物二聚体等二级结构也需要被消除掉,这里使用了一种被称为“Hands”的方法[5],还是刚刚提到的5端标签,这里上下游使用的标签是相同的,因此上下游引物延伸出的两条单链,如果扩增产物的长度不长,会自发形成以标签为茎部的茎环序列,茎环序列的Tm值高于引物二聚体的Tm值。既不影响高温变性打开后作为模板参与下一轮延伸,又可以阻止引物非特异性的形成二聚体。引物即使和茎环的茎部能发生互补,其延伸也会受到抑制。
通过扩增和检测技术的优化,MeltArray可以实现远超4-6重的检测能力。之前提到报告系统可以允许多个中介引物的结合,经过优化后单个荧光通道理论上可以达到12个靶标。结合宏石SLAN96S上的六个荧光通道Atto 425 (450 nm),FAM,HEX (565 nm),ROX,Cy5和 Quasar 705 (705 nm)。最终可以同时在单管中完成72个靶标的同时检测,这无疑是重大的突破,实现了荧光定量PCR向阵列式的转变。
参考文献
[1] Qiuying Huang, Zanzan Liu, Yiqun Liao, Xiaoyun Chen, Yi Zhang, Qingge Li. Multiplex fluorescence melting curve analysis for mutation detection with dual-labeled, self-quenched probes. PLoS One. 2011 Apr 28; 6(4): e19206.
[2] Bernd Faltin, Simon Wadle, Günter Roth, Roland Zengerle, Felix von Stetten. Mediator probe PCR: a novel approach for detection of real-time PCR based on label-free primary probes and standardized secondary universal fluorogenic reporters. Clin Chem. 2012 Nov; 58(11): 1546-56.
[3] Qiuying Huang, Dongmei Chen, Chen Du, Qiaoqiao Liu, Su Lin, Lanlan Liang, Ye Xu, Yiqun Liao, Qingge Li. Highly multiplex PCR assays by coupling the 5'-flap endonuclease activity of Taq DNA polymerase and molecular beacon reporters. Proc Natl Acad Sci U S A. 2022 Mar 1; 119(9): e2110672119.
[4] Hui Shi, Quoclinh Trinh, Wentao Xu, Baiqiang Zhai, Yunbo Luo, Kunlun Huang. A universal primer multiplex PCR method for typing of toxinogenic Pseudomonas aeruginosa. Appl Microbiol Biotechnol. 2012 Sep; 95(6): 1579-87.
[5] J Brownie, S Shawcross, J Theaker, D Whitcombe, R Ferrie, C Newton, S Little. The elimination of primer-dimer accumulation in PCR. Nucleic Acids Res. 1997 Aug 15; 25(16): 3235-41.
.png)

