早在近二十年前﹐Gibco™ CTS™ Dynabeads™ CD3/CD28 技术就已经应用于开创性的临床获准 CAR-T 细胞治疗[1]。抗体包被的磁珠在生产工艺中至关重要﹐可以实现一步式细胞分离和激活﹐并且能够在2-3 周内完成临床规模的剂量生产。从那时起﹐这项技术就已经得到业界公认﹐迄今为止已经在200多项临床试验中使用﹐为患者提供急需的治疗。尽管取得了这些成功﹐但在进一步提高可靠性﹐一致性以及治疗效果的持久性方面仍然存在挑战。此外﹐仍需要加快并扩展对患者的治疗交付[2]。
研究和临床结果表明﹐提供更高质量的早期 T 细胞表型库是提高可靠性和治疗效果持久性的关键[3]。为了帮助生产所需的表型﹐现已开发出Gibco™ CTS™ Detachable Dynabeads™ CD3/CD28 试剂盒(主动释放磁珠)。该试剂盒基于采用 CTS Dynabeads CD3/CD28 磁珠(被动释放磁珠)进行的一步式分离和激活﹐而且在激活后的任何时间点通过用户定义的主动释放磁珠解离来提供激活控制。这种特性旨在帮助保存早期 T 细胞表型﹐同时将 T 细胞的生产工艺缩短至数天。此外﹐该试剂盒兼容可扩展的封闭式和自动化 Gibco™ CTS™ DynaCellect™ 磁性分离系统。
在一项实验室规模的比较研究中对 CTS Detachable Dynabeads CD3/CD28 试剂盒进行了评价﹐以评估其相对于被动释放磁珠﹐在 T 细胞激活以及激活后细胞扩增﹐CD4+:CD8+ 比率和早期表型方面的性能。使用 CTS DynaCellect 磁性分离系统对主动释放磁珠进行了另一项研究﹐旨在评估 T 细胞纯度﹐分离效率以及在激活后不同日期释放磁珠时的激活水平。
材料和方法
实验室规模的比较研究
细胞
在培养基中恢复此前从7名健康供体分离的 CD3⁺/CD28⁺T 细胞冷冻样品瓶中的细胞。为了获得相同的激活起始材料﹐使用 Invitrogen™ Dynabeads™ Untouched™ 人 T 细胞试剂盒(目录编号 11344D)从健康供体的外周血单个核细胞(peripheral blood mononuclear cell﹐以下简称 PBMC)中阴性分离 T 细胞。使用 Vi-CELL™ XR 细胞分析仪 (Beckman Coulter) 评价细胞计数和细胞活力。
培养基
在不含酚红的 Gibco™ CTS™ OpTmizer™ T 细胞扩增SFM(目录编号 A3705001)中添加 2.5% Gibco™ CTS™ 免疫细胞SR(ICSR;目录编号 A2596101)和 4 mM L-谷氨酰胺。按照说明在培养物中添加 Gibco™ 重组人IL-2(目录编号 PHC0023)。
激活
以 1 x 10⁶ 个细胞/mL 的密度将细胞接种于 6 孔板内总体积为2 mL 的培养基中。添加 100 IU IL-2 后﹐以3 个磁珠∶ 1 个 T 细胞的比例使用 Gibco™ Dynabeads™ CD3/CD28 磁珠(目录编号11141D)或 CTS Detachable Dynabeads CD3/CD28 试剂盒(目录编号A56992)激活细胞。第 3 天时﹐使用提供的试剂盒缓冲液去除主动释放磁珠。使用 Invitrogen™ DynaMag™-2 磁铁(目录编号12321D)手动去除被动释放磁珠。
扩增
第 5 天时﹐将细胞转移至 12 孔板内﹐并以 0.5×10⁶ 个细胞/mL的密度在 2 mL 培养基中培养至第 10 天。在第 3 天﹐第7 天和第10 天时评价细胞计数和活力。
性能标准
在 Invitrogen™ Attune™ NxT 流式细胞仪上﹐使用相应的标记抗体通过流式细胞分析评价 CD25 激活情况以及细胞表型标记物CD4﹐CD8﹐CD27﹐CCR7﹐CD62L﹐CD45RO 和 CD3。
在封闭式自动化系统中进行的
主动释放磁珠研究
细胞
从4名健康供体的冷冻白细胞单采物中恢复 PBMC﹐无需洗涤﹐使用DPBS 和1%人血清白蛋白(human serum albumin﹐以下简称HSA)解冻缓冲液进行1:1稀释。使用 NucleoCounter™NC-3000™ 系统(ChemoMetec) 评价细胞计数和细胞活力。
培养基
在不含酚红的袋装 CTS OpTmizer T 细胞扩增 SFM(目录编号 A3705003)中添加 2.6% CTS OpTmizer 扩增添加剂﹐2.5% CTS免疫细胞 SR﹐2 mM L-谷氨酰胺﹐0.0125 mg/mL 庆大霉素和100,000 IU Invitrogen™ 人 IL-2 重组蛋白(目录编号 RP-8608)。
分离和激活
第 0 天时﹐以 3 个磁珠∶1 个 CD3+ T 细胞的比例使用 Gibco™ CTS™ DynaCellect™ 磁性分离系统(目录编号 A55867)和 Gibco™ CTS™ DynaCellect™ 分离试剂盒(目录编号 A52300)分离并激活 4.0 x 10⁸ 个细胞。收集阳性和阴性组分。对阳性组分的等分试样进行第 0 天细胞纯度评价。剩余的阳性组分用培养基转移至 3 个 1 LG-Rex™ 100M 开放系统容器 (Wilson Wolf)。激活后第 1 天﹐第 2天和第 3 天时﹐各将一个 G-Rex 容器的细胞转移至 CTS DynaCellect 磁性分离系统﹐使用 CTS DynaCellect 分离试剂盒进行磁珠释放。
性能标准
使用 Attune NxT 流式细胞仪和相应的标记抗体﹐基于流式细胞分析评价 T 细胞纯度﹐CD69和 CD25激活标记物以及 CD3⁺/CD28⁺ 和 CD3⁺ 细胞的分离效率。使用以下方程式计算分离效率:分离效率 (%) =1 - [(阴性细胞组分中的平均 CD3⁺CD28⁺ 细胞百分比) x (平均计数 x 体积)]/[(平均 CD3⁺CD28⁺ 输入百分比) x(平均计数 x 体积)] x 100%。
结果
实验室规模的比较研究
激活后第 3 天时﹐无论使用被动还是主动释放磁珠﹐CD25 标记物的平均表达水平均>90%(图1)。此外﹐在激活后第7天和第10天时﹐分别显示出接近 20 倍和 60 倍或更高的平均细胞扩增(图2)。细胞活力保持在接近90%或更高﹐直到第10天(数据未显示)。使用 CTS Detachable Dynabeads CD3/CD28 磁珠激活细胞时﹐第7天和第10天时的平均 CD4+:CD8+比率与使用被动释放磁珠时的结果相当(图3)。最后﹐CCR7⁺/CD62L⁺﹐CD27⁺/CD62L⁺ 和 CD45RO⁺/CD62L⁺ 标记物表型的表达水平证实﹐使用主动释放磁珠激活的细胞在第 10 天时能够保持相似的早期记忆表型(图4)。
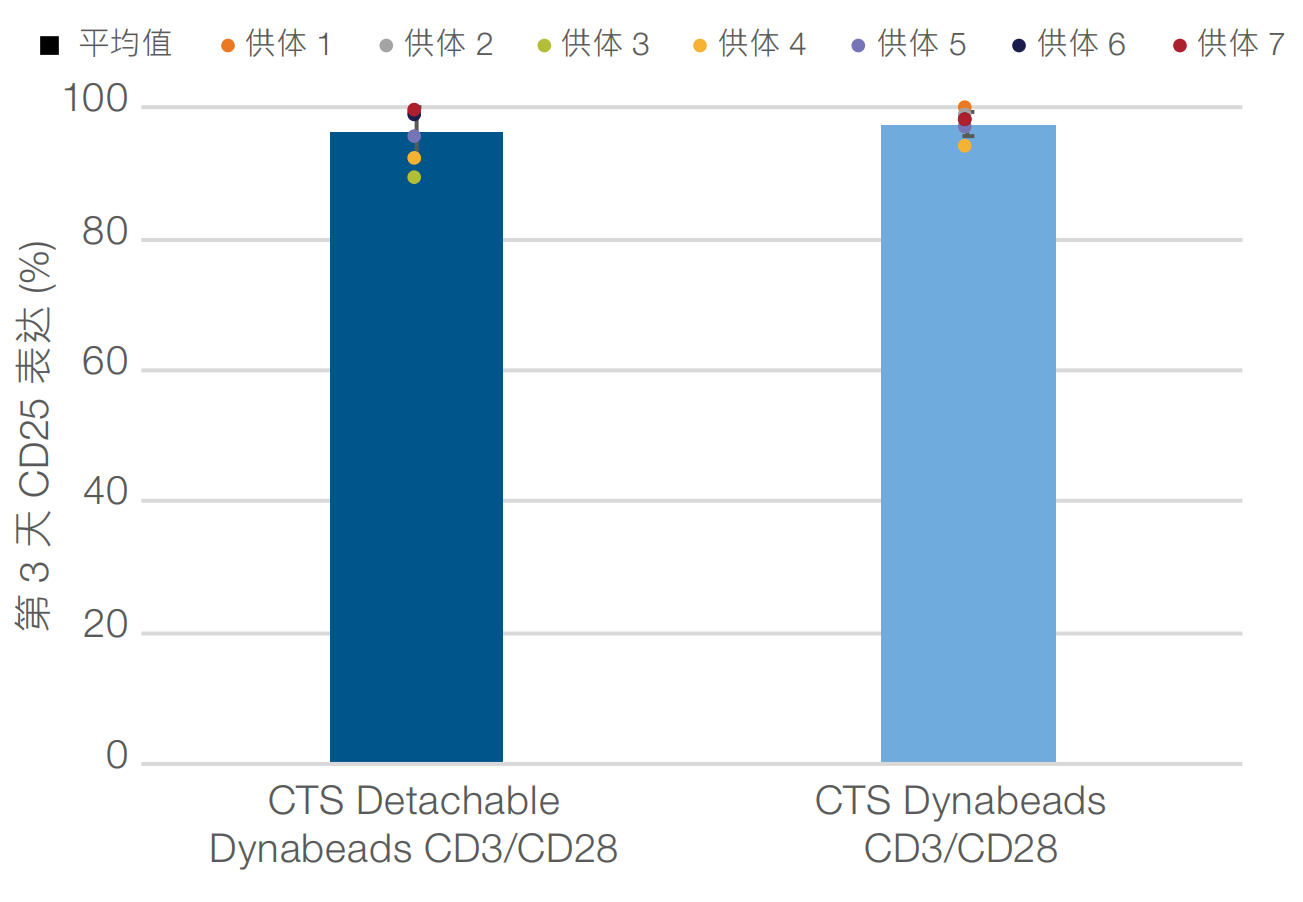
图 1.主动释放磁珠支持与被动释放磁珠相当的高度 T 细胞激活水平。激活后第 3 天时﹐使用主动和被动释放磁珠激活的 T 细胞均显示出很高的 CD25 激活标记物平均细胞频率 (>90%)。
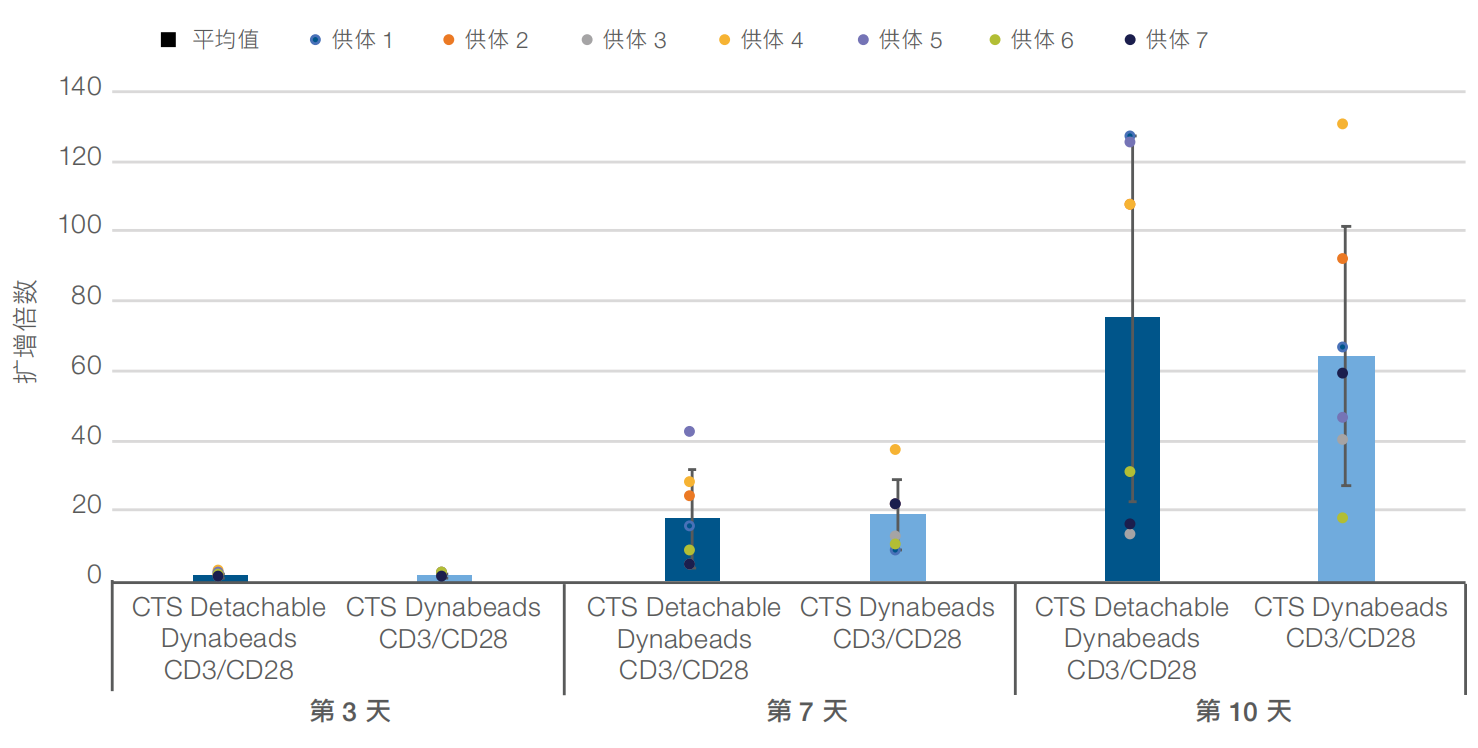
图 2.使用 CTS Detachable Dynabeads CD3/CD28 试剂盒激活后得到相似的细胞扩增。使用主动和被动释放磁珠激活后得到相似的 T 细胞扩增﹐第 7 天时平均增幅近 20 倍﹐第 10 天时平均增幅 60 倍或更高。细胞活力保持在接近 90% 或更高﹐直到第 10 天(数据未显示)。
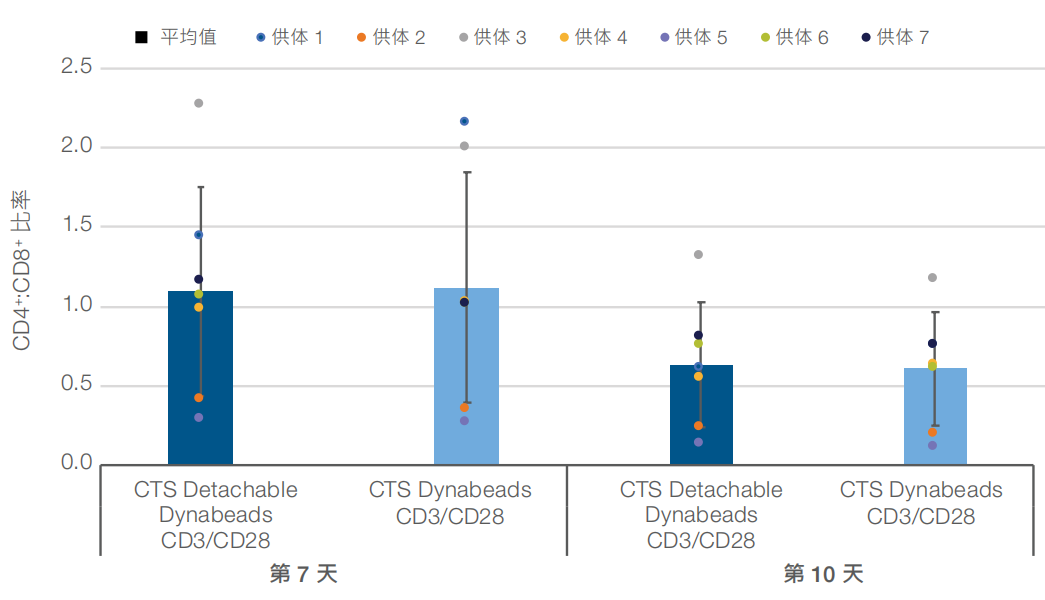
图 3.使用 CTS Detachable Dynabeads CD3/CD28 试剂盒时得到相似的CD4+:CD8+ 比率。第 7 天和第 10 天时﹐使用主动释放磁珠激活的细胞的平均 CD4+:CD8+ 比率与使用被动释放磁珠激活的细胞相当。
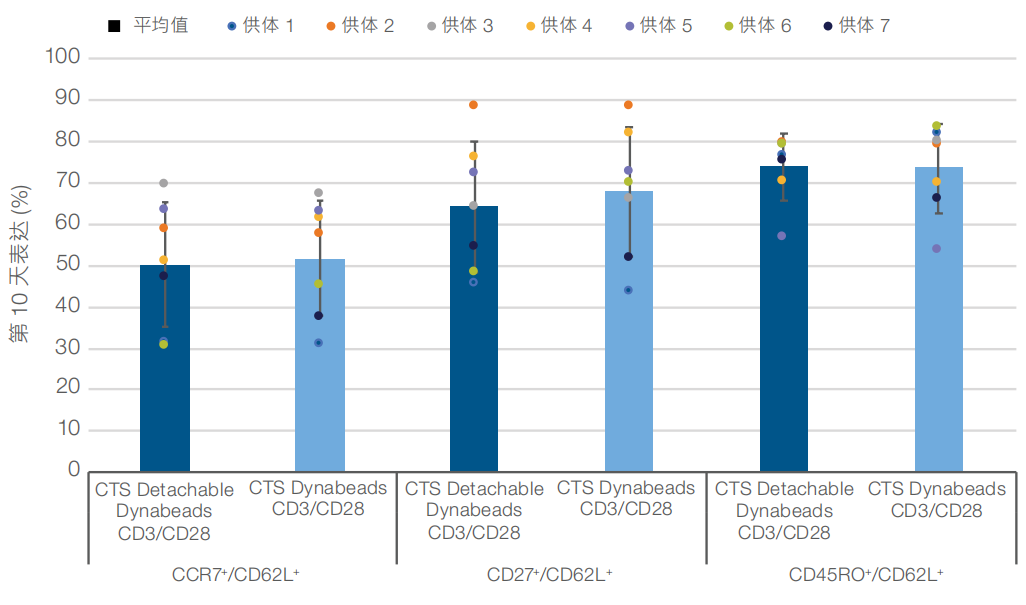
图 4.使用 CTS Detachable Dynabeads CD3/CD28 试剂盒时显示出相似的 T 细胞记忆表型。第 10 天时﹐与使用 CTS Dynabeads CD3/CD28 磁珠激活的细胞相比﹐使用主动释放磁珠激活的细胞显示出相似的早期表型(CCR7⁺/CD62L⁺,CD27⁺/CD62L⁺ 和CD45RO⁺/CD62L⁺)平均表达水平。
结果与讨论
这项比较研究表明﹐CTS Detachable Dynabeads CD3/CD28 试剂盒的性能与现有的被动释放磁珠类似﹐能够提供符合预期的一步式高纯度分离﹐稳健激活﹐细胞扩增以及所需的早期记忆细胞表型。
在 CTS DynaCellect 磁性分离系统中进行的主动释放磁珠研究证实了该试剂盒以高纯度和稳健分离效率交付靶 T 细胞的能力。此外﹐我们发现 T 细胞在第 2 天或第 3 天激活后能够达到接近完全激活。主动磁珠释放功能为用户提供了在其流程中的任何时间点分离磁珠的灵活性。这可以允许更好地控制工作流程﹐并能够产生所需的早期T 细胞表型。 CTS Detachable Dynabeads CD3/CD28 试剂盒与 CTSDynaCellect 磁性分离系统结合使用﹐可以在自动化﹐可扩展和封闭式生产环境中提供更一致和标准化的 T 细胞生产。
CTS Detachable Dynabeads CD3/CD28 试剂盒和 CTS DynaCellect 磁性分离系统能够支持细胞治疗产品生产行业对更灵活和更稳健工艺的需求﹐从而提供始终如一的高质量治疗产品。总之﹐这些产品显示出强大的潜力﹐可以帮助细胞治疗产品生产商为患者提供增强﹐有效﹐一致和及时的细胞治疗。
来源于优宁维药物研发官网

