去年九月,Nature biotechnology通过一篇新闻介绍了突破血脑屏障(BBB,Blood-Brain Barrier)的药物递送创新技术和相关临床进展[1]。与PROTAC药物的发展类似,该领域的变革依然离不开数十年的努力和生物技术的进步。在今天的推送中,我们就来聊聊科学家是如何与BBB“化干戈为玉帛”。

从BBB到RMT
(Receptor-mediated transcytosis)
早在BBB生理结构的发现之前,Paul Ehrlich(对,就是"Magic bullet"概念的提出者)和其学生Edwin Goldman通过一系列的动物染料注射实验,观察到外周(或者大脑)注射的染料,不能染色大脑(或者外周器官),暗示着血液和大脑之间存在着屏障[2,3]。
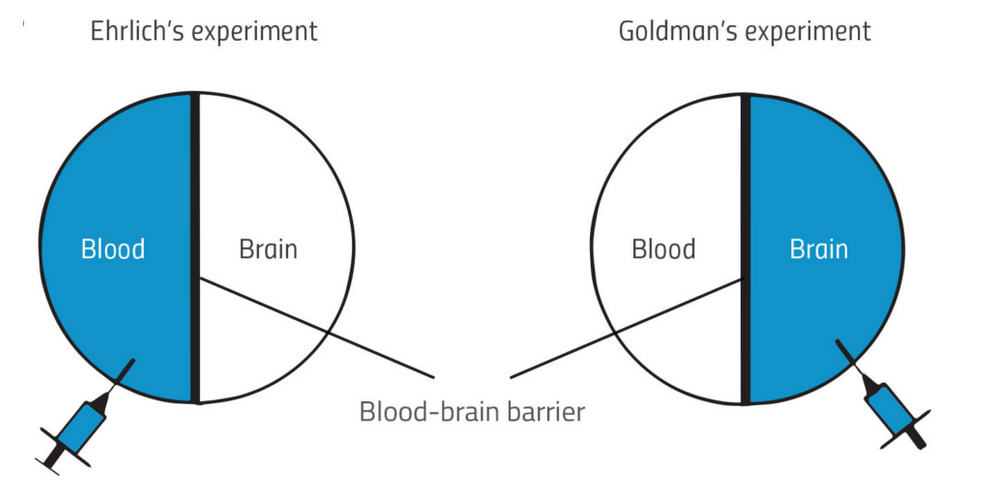
图片来自于[2]
随后,在电镜技术和辣根过氧化物酶等的帮助下,BBB的核心结构,脑血管内皮细胞(Brain Endothelial Cells,BECs)得以浮出水面。然而,要发挥BBB的功能,BECs还需要和星形胶质细胞、小胶质细胞、周细胞(Pericyte,也很重要)和神经细胞等相互协作。这些细胞联盟行成的动态结构称之为NVUs(Neurovascular unit,名副其实的A tight unit)。
从结构上就可以看出,BBB作为大脑内环境的核心管家,有效阻止有害的化合物、白蛋白和抗体(防止炎症反应)等大分子的进入。同时,BECs具有高效的外排转运体系(例如ABC和SLC家族),进一步限制一些化合物的通透性。BBB的这一特性也成为了CNS疾病药物,尤其是大分子药物(通常仅有0.01-0.1%的通过率)研发难以避免的核心挑战(A formidable challenge)。值得一提的是,BBB的屏障能力会受年龄、疾病等因素影响。这也为某些疗法提供了契机,例如针对两岁以下儿童的诺华AAV9基因疗法。
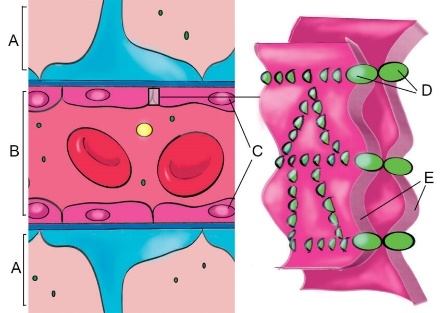
左图,BBB的主要结构A: 大脑侧; B: 血管侧; C: 内皮细胞; D: 紧密连接(Tight junction, TJ,BBB特色结构); E: 内皮细胞膜;右图:NVU主要细胞群体[2]。
但与此同时,我们不能被“屏障”二字所误导。通过被动和主动运输的形式,BECs积极、高效地转运着大脑所需的脂类、糖类和氨基酸等大小分子和养分等[下图左]。这时,内皮细胞具有的转胞吞作用(Transcytosis)就派上了用场[下图左A和B] [4]。从内吞步骤上看,其包括受体介导的RMT(本篇主角,也是蛋白转运的主要形式,主要由Clathrin蛋白调控内吞)和吸收介导的AMT(Adsorptive-mediated transcytosis,主要由Caveolae参与内吞,也可以用于开发CNS药物递送)。内吞后,转运的蛋白也不是都能顺利地抵达彼岸,还可能逃不过降解和回运的命运[下图右] [4]。因此,胞内的亚细胞运输对于RMT效率异常关键。最后,RMT本身也参与了CNS疾病一些重要致病蛋白,如Abeta的转运。且BECs上面也表达一些重要的药物靶点,如胰岛素受体等。这些也为深入的机制研究和新药开发提供了切入点。
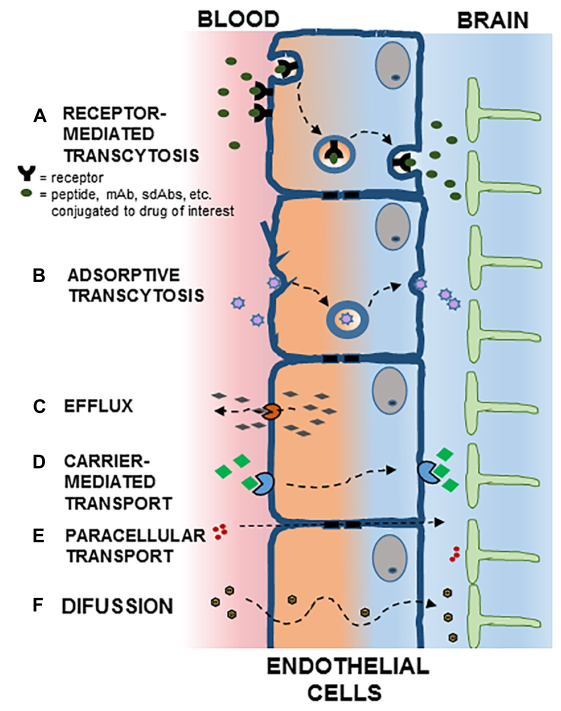
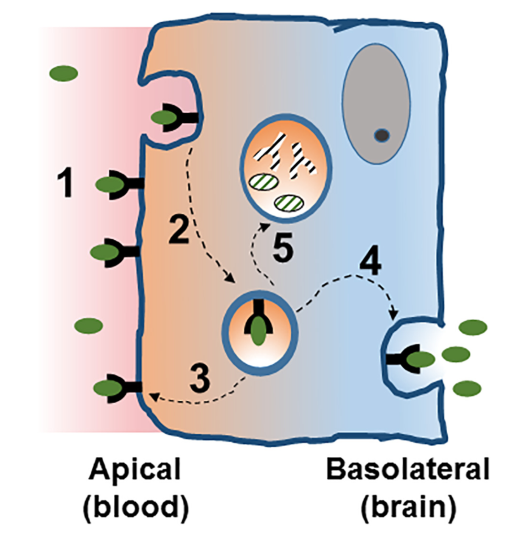
左图,跨越BBB运输的主要机制;右图,简化的RMT流程[4]
“特洛伊木马”
为了克服BBB的挑战,现阶段已有多种潜在策略用于CNS的药物递送,例如定向超声、鼻腔注射和纳米材料等,或者直接利用能有效穿透BBB的药物,如已批准的抗抑郁药物开展联合用药开发。然而上述策略的安全性、有效性和与当下主流大分子生物药的兼容性有限。于此同时,RMT作为大脑摄取(特定)必需大分子的首要机制,且考虑到大脑内丰富的血管结构和覆盖度(面积可达15-25m2)。那么,能否像利用高效的泛素-蛋白酶体系统的PROTAC药物一样,借助(Hijack)BECs 的RMT系统来设计能突破BBB的双特异结合药物?答案是肯定的,而这类通过利用抗体或者天然/改造配体来靶向RMT (转运)受体,进而达到大脑实质递送的双特异抗体、融合蛋白或者功能化的纳米载体等,也被称为“特洛伊木马”。该策略能有效提升药物的BBB穿透能力。以主流的转运受体Transferrin Receptor(TfR)为例,同一分子通过结构改造识别TfR,可提升大脑浓度的20-30倍。该策略的出现,也为一些之前受挫的传统大分子药物提供了新的希望[见下表格][1] 。
在蛋白改造技术的推动下,目前已有多种形式的双特异大分子药物进入临床或临床前研究[下表格],其中比较代表的是Denali的TV (Transport vehicle)技术平台,该平台与传统的双特异抗体结构不同,而是针对抗体的Fc段进行突变文库筛选和改造,用于识别潜在的转运受体[下图](类似的平台公司还有Bicycle Therapeutics和Bioasis Technologies)[5]。
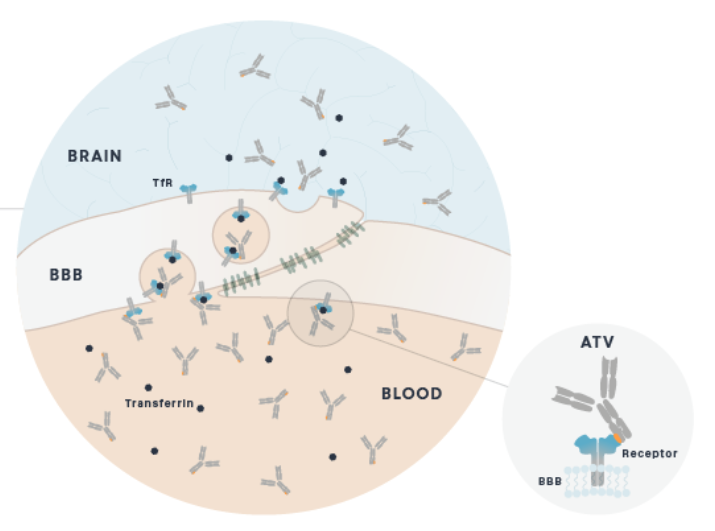
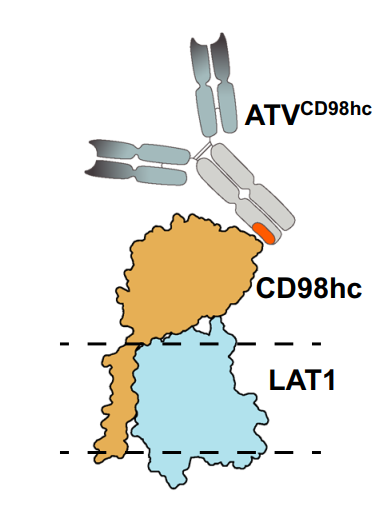
Denali的TV平台原理[5]和靶向CD98hc的ATV示意图[6]

至此,我们就回到了开篇的新闻。文章介绍了经典的转运受体靶点如TfR,和新兴靶点CD98等的相关研发和临床进展(常见的转运受体靶点,如LRP-1等进展可参考综述[4])。而从药物本身来看,除了形式的创新外,其和转运受体的亲和力(根据不同的机制需求不同),表位特异性和结构(单/双价结合)等对其转运效率也非常关键,也是当下研发和应用开发的关注点。此外,新型药物的一些结构,如Fc片段带来的安全性影响也值得深入研究。最后,除特洛伊木马外,AAV为主导的病毒载体也在CNS递送方向得到了迅速的发展,未来可期。
小结
与开启肿瘤治疗新领域的PROTAC药物类似,利用RMT的双特异大分子药物也在迅速变革CNS药物的研发策略。除了抗体药外,RMT的灵活性也为酶、重组蛋白等大分子药物和核酸药物开辟了新的潜能。同时,与PROTAC一样,药物形式和机制的创新也为研发中涉及的筛选、(体外/体内)模型和活性评价等应用方向提出了新的挑战和需求,也是Revvity当下的关注点。我们会聚焦机制(Mechanism)、模型(Model)和药物形式(Modality)三个重心方向,结合多维度的创新应用方案,推动高价值RMT受体的挖掘和更有效、安全的双特异大分子药物研发和评价工作,敬请期待。

