抗体-药物偶联物(ADC)的药抗比(DAR)对其治疗效果和药代动力学具有重要意义,因此在合成过程中DAR的控制是ADC质量控制的关键。ADC的抗体去糖基化可以简化DAR的测量,本文中作者通过去糖基化处理和LC-MS检测,在15分钟内快速进行DAR分析,从而实现实时DAR监测,以优化ADC合成过程。这种方法可以有效地筛选合适的偶联条件,并提供具有预期DAR的ADC。适用于随机赖氨酸连接ADC、糖苷特异性ADC (gsADCs)和复杂的双载荷ADC(dpADCs)。
01
ADC的合成
作者合成了随机赖氨酸连接的ADC(4和5),dpADC(6)和gsADC(9)。使用了两种细胞毒素DM1 (N2′-去乙酰基-N2′-(3-巯基-1-氧代丙基)-美登素)和MMAE(Monomethyl auristatin E),以及经典连接子SMCC(4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯)。这些ADC的合成路线如图1所示。
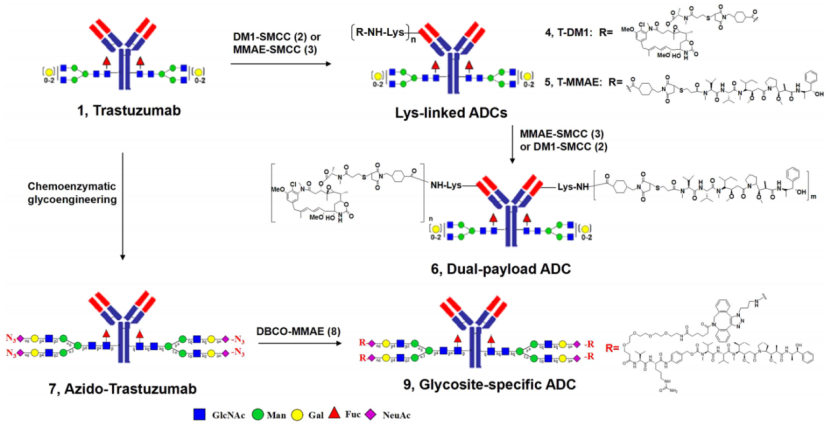
图1. 赖氨酸连接ADC、双载荷ADC和糖苷特异性ADC的合成
02
通过LC-MS分析ADC的最佳去糖基化步骤
作者开发用于DAR检测的快速LC-MS分析,可用于实时监测。作者首先优化了ADC分析的去糖基化过程。以往常常使用来自脑膜炎黄杆菌的肽-N-糖苷酶(PNGase F)对ADC进行去糖基化,它作用于第一个糖N-乙酰葡萄糖胺(GlcNAc)和Asn297侧链之间的酰胺键,释放抗体上的游离N-聚糖(图2A)通过去除混合糖型,抗体的质谱变得均质,MS谱图将ADC(图3C和F)简化为仅混合不同载荷数的m/z值。DAR很容易计算为基于所有反卷积质量强度总和的平均有效载荷数。
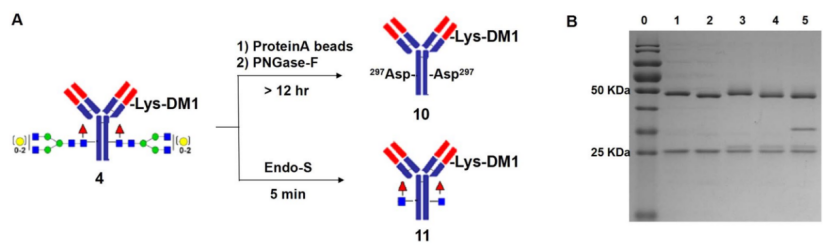
图2. 用PNGase F和Endo-S进行ADC去糖基化
(泳道0:Maker,泳道1:单抗,泳道2:用Endo S去糖基化单抗,泳道3:ADC 4,泳道4 :用Endo S去糖基化ADC 4,泳道5:用PNGase F去糖基化ADC 4)
使用PNGase F对IgG的去糖基化通常需要较长时间,无法实现实时监测。因此作者选用来自化脓性链球菌(Endo S)的N-乙酰葡糖胺苷内切酶,该酶可快速去糖基化,用于ADC去糖基化和实时DAR检测。试验结果表明,Endo S在低浓度下,5min内完全切割GlcNAcβ1,4GlcNAc基序之间的聚糖(图2),且未检测到Endo S的条带。而PNGase F需要更高的酶浓度和超过12小时的孵育才能完成去糖基化,并且有残留(图2B,泳道5)。更重要的是,由于PNGase F的消化时间较长,ADC的药物偶联可能仍在进行,在去糖基化过程中DAR值可能会升高,因此在PNGase F方法进行去糖基化和DAR检测之前,需要用protein A亲和层析对ADC进行预纯化。
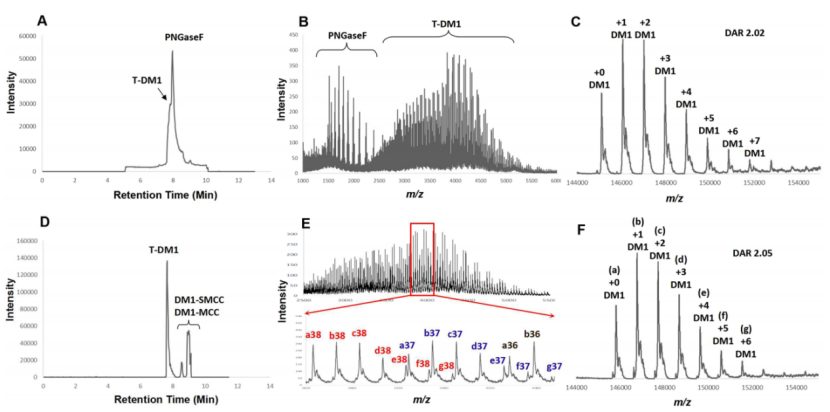
图3. PNGase-F (A,B,C) 和Endo S (D,E,F) 测定去糖化ADC 4的数据比较
作者进一步通过LC-MS比较Endo S和PNGase F处理ADC后的DAR的测定数据。由于PNGase F酶的浓度较高,在总离子色谱图(TIC)和MS检测中观察到两种蛋白(图3B)。反卷积数据(图3C)显示一系列MS峰被分配为ADC,载荷数增加,DAR计算为2.02。相比之下用Endo S处理的ADC 4的TIC谱图(图3D)显示ADC 4是唯一的蛋白部分,没有检测到痕量的Endo S。小分子试剂(DM1-SMCC)及其衍生物在反应等分物中未经预纯化,也在TIC图中观察到,并且与蛋白质部分完全分离。结果展示了ADC的多电荷m/z,放大质量范围内的各个峰被分配并标注了其去卷积质量和电荷数(图3E,F)。用Endo-S测定的 ADC 4的DAR为2.05,与 PNGase-F方法检测到的DAR高度一致,表明两种方法的一致性和可靠性。从这些对比数据来看,Endo-S方法在快速脱糖、色谱中对ADC的分离以及用于实时监测的反应等分物的高效检测方面都表现出了明显的优势。
03
通过实时DAR监测优化ADC赖氨酸偶联条件
为了快速分析DAR,作者开发了一个15分钟的流程,即5分钟的Endo S去糖基化和10分钟的LC-MS测定。为了将此方法应用于ADC赖氨酸偶联的实时监测,作者建立DM1-SMCC与赫赛汀(曲妥珠单抗)的模型反应进行监测。为了优化偶联条件,作者在不同的磷酸盐缓冲液以及不同的时间间隔下,测量反应当量进行DAR分析(图4)。结果发现,ADC的赖氨酸偶联的最佳pH条件为pH 7.5左右。
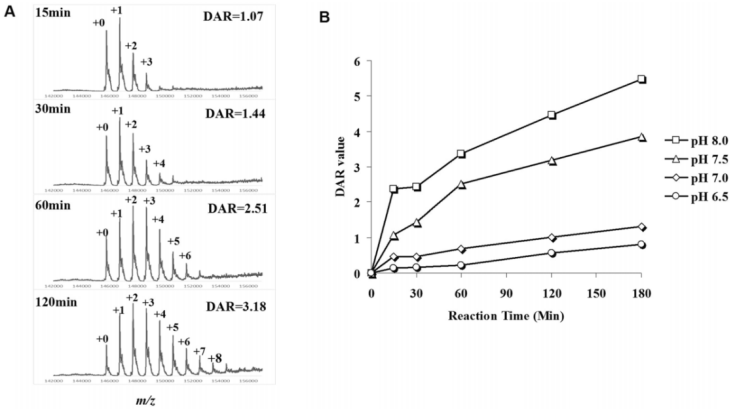
图4. 赖氨酸偶联ADC的实时DAR检测
04
dpADC(6)和gsADC(9)的实时DAR监测
作者进一步扩展了该方法在双载荷ADC (dpADC)中的应用,dpADC携带两个不同的有效载荷,每个有效载荷具有单独的DAR值。为了将两个有效载荷的总DAR控制在~3.5,需要将每个有效载荷的DAR控制在1.5 - 2.0范围内。因此作者在实时监测下将药物a (DM1)偶联在赫赛汀上,直至药物a的DAR为~1.6。然后,通过protein A亲和柱纯化ADC,加入药物b (MMAE)。连续监测第二轮偶联,直到总DAR (DARa+DARb)达到期望值(~3.5)。将解卷积的MS峰分配给相应的ADC分子,并计算药物a和药物b的编号(标记在单个峰的顶部)。然后根据质谱强度分布计算DARa和DARb(图5)。
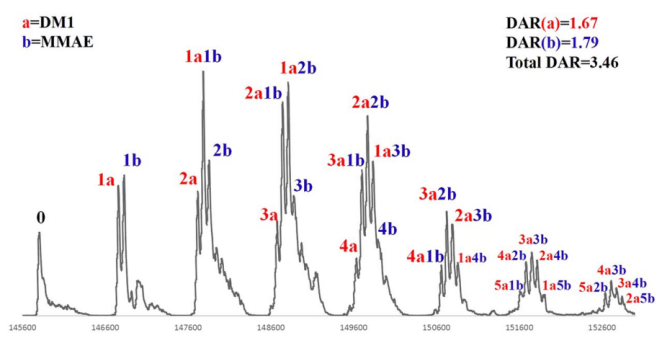
图5. dpADC(6)的MS谱及DAR分析
此外,实时LC-MS测定还可用于化学酶糖工程和点击反应的监测。叠氮化修饰的赫赛汀(7)和DBCO-MMAE(8)的点击反应直接由LC-MS监测(图6)。DAR随反应时间的延长而增加。24小时后,总共四个叠氮基团的偶联基本完成(图6F)。这些监测数据表明,点击偶联可以进一步优化以缩短反应时间,并且观察到部分分解的质量(图6,D-F中星号标记)表明连接子的稳定性也需要进一步提高。这些数据表明,实时LC-MS测定是DAR分析和控制各种ADC亚型的有力工具。
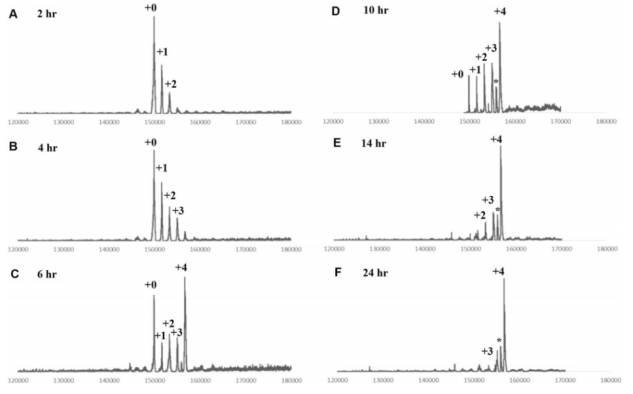
图6. gsADC的实时DAR分析
05
IgG去岩藻糖的实时监测
除了DAR检测,IgG重链的实时LC-MS分析也被用于抗体的化学酶糖工程。作者使用了一种来自干酪乳杆菌的岩藻糖苷酶(AlfC)来水解经 Endo-S 消化得到的IgG-Fucα1,6GlcNAc 上的岩藻糖。通过SDS-PAGE分析无法监测脱褐藻糖基化,因为质量减少(146Da)太小,无法通过 IgG 重链的带移检测到。而完整IgG的精确MS分析则可以更好的监测脱糖基化。IgG-Fucα1,6GlcNAc 显示了一个均匀的质量峰(图7A),标记为2F(两条重链中均含有2个岩藻糖苷)。
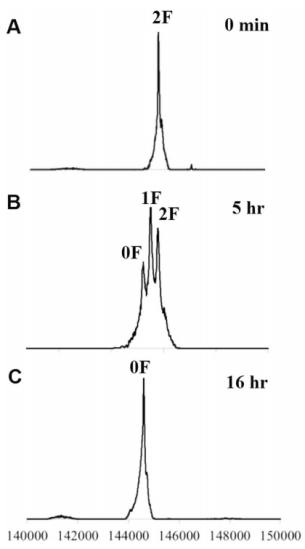
图7. 实时监测IgG去岩藻糖质谱图
用 AlfC 处理5小时后(图7B),岩藻糖被部分去除,质谱图显示出2F(2 个岩藻糖)、1F(1个岩藻糖)和0F(无岩藻糖)的混合糖形。16小时后,去岩藻糖基化完成,只观察到0F 峰。该分析方法已成功应用于各种ADC亚型的DAR监测,并实现对DAR和ADC合成过程的质量控制。同时也为监测小质量变化的IgG修饰(如去岩藻糖)提供了一个完美的解决方案。
参考文献:
Tang Y, Tang F, Yang Y, Zhao L, Zhou H, Dong J, Huang W. Real-Time Analysis on Drug-Antibody Ratio of Antibody-Drug Conjugates for Synthesis, Process Optimization, and Quality Control. Sci Rep. 2017 Aug 10;7(1):7763.
来源于优宁维药物研发官网

