免疫磁分选
Cell Seperation
免疫磁分选是细胞分选的常用方法,然而要做好并不简单,除了笼统的纯度和得率,您是否有过如下困扰?
-
要进行功能实验,担心细胞激活或活性受损?
-
想对分选所用的marker再进行流式分析,表位被阳选磁珠占据难以染色?
-
感兴趣的细胞类型丰度特别低,不想错失一个目的细胞?
-
实验结果不及预期,找不到明确原因,怀疑细胞有问题?
不要愁,美天旎MACS®分选技术从不妥协,纯度、得率、活性、功能、游离表位、下游应用……满足你既要又要还要,统统都要!
王炸组合: MACS分选柱+50nm磁珠
MACS技术的奥秘在于采用了独特的MACS分选柱和50nm磁珠组合。分选柱填充有不同规格的铁珠,将磁场放大10000倍,因此只需要非常少量且“小身材”的磁珠标记,即可有效分选细胞。而无柱式分选磁场梯度低,只能通过大量磁珠或是微米级的“大块头”磁珠标记来弥补。
对于不同的分选柱,铁珠之间的空间在250-500μm,是白细胞直径的10倍以上,细胞可以自由流穿,不会有挤压或黏着。而MACS磁珠的直径只有50nm,是目前市面上最小的分选磁珠。
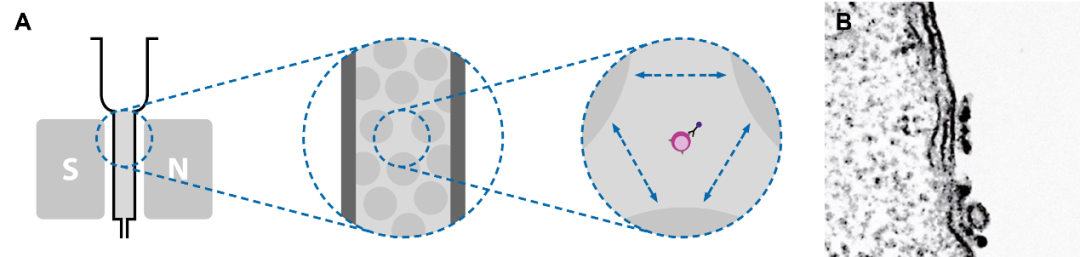
图1 MACS技术一览,(A) MACS分选柱示意图,(B)透射电镜下的MACS磁珠。
最少量标记,明白看得见
使用电镜观察磁珠标记的细胞,能够直观地“看见”MACS技术最少量标记和无柱式分选过量标记的区别。另外无柱式分选的过量标记有可能完全占据细胞表面的抗原表位,导致下游流式分析变得困难甚至无法使用分选marker再进行流式分析。而MACS技术只做少量标记,保留了大量游离的表位,分选后无需解离磁珠,可以直接用分选所用的marker进行流式分析。
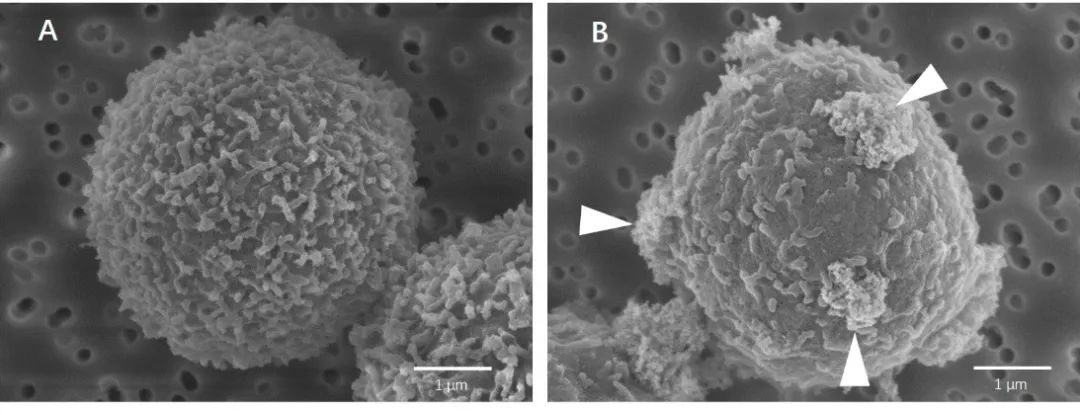
图2 磁分选的CD3细胞的扫描电镜图像,(A)为MACS技术分离的细胞,没有明显标记或外观改变,(B)是用其他品牌纳米级磁珠和无柱式技术分离的细胞,箭头指示过度标记。
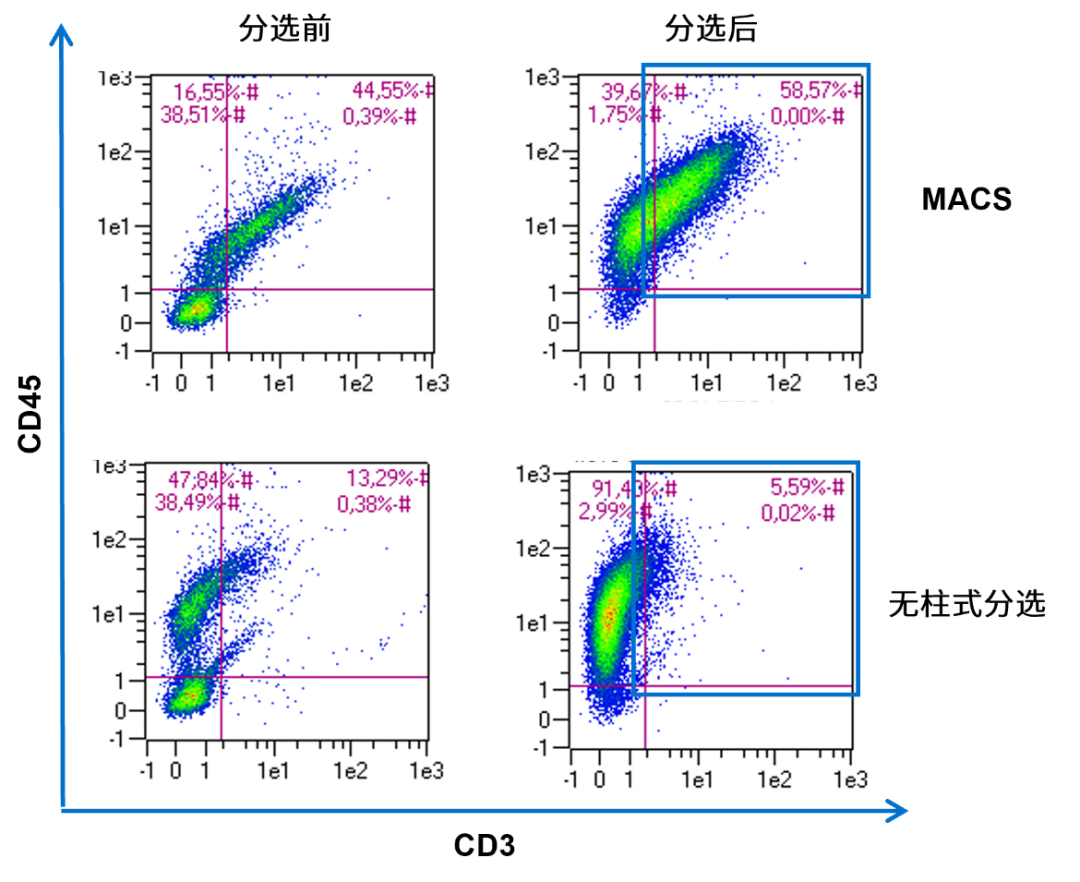
图3 使用CD3流抗染色后流式检测阳性选择的人CD3 细胞,MACS技术分选的细胞很容易用流式检测,而无柱式系统分选的细胞无法用流式检测,因为大量的磁珠标记导致流抗染色的封闭效应。
高纯度,高得率
由于只需标记最少量的纳米磁珠,MACS技术的磁珠标记高度特异,既不遗漏阳性细胞,也不发生阴性细胞的非特异结合,平均纯度和回收率能够达到90%以上。对于某些具体的细胞分选,有文献报道MACS分选的细胞纯度高于无柱式分选系统[1,2]。
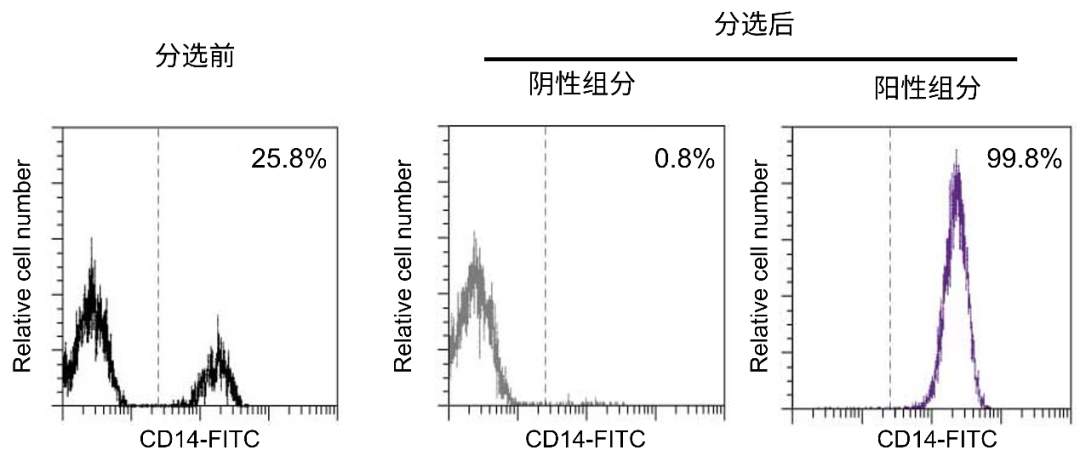
图4 使用人CD14 MicroBeads从PBMC中分离单核细胞,流式检测分选前和分选后样本中的CD14阳性细胞占比,分选后阳性组分纯度达到99.8%,阴性组分只有0.8%。
安全无刺激,保护细胞活性与功能
阳性选择(Positive selection)使用磁珠标记目的细胞,其优势在于靶向性高,可控性高,获得的细胞纯度高,尤其是对稀有细胞的富集。而且操作简便,样本适用性广,比如从全血、单采血等血制品直接分选细胞,或是对含有大量碎片的样本进行细胞分选。如果要进行间接标记分选,通常也都是采用阳性选择策略。
美天旎的CliniMACS系统和CD34阳选磁珠早在2014年就获得美国FDA批准用于急性髓系白血病的造血干细胞移植治疗,安全性毋庸置疑。值得一提的是目前获批的ATMP(先进治疗药物)类的细胞治疗产品,全都是基于阳性选择的。但是相比于MACS技术的最少量标记,无柱式分选由于需要进行过量的磁珠标记,有文献报道可能引发对细胞的激活[3],因此有些无柱式分选系统厂家更为推荐阴性分离策略。
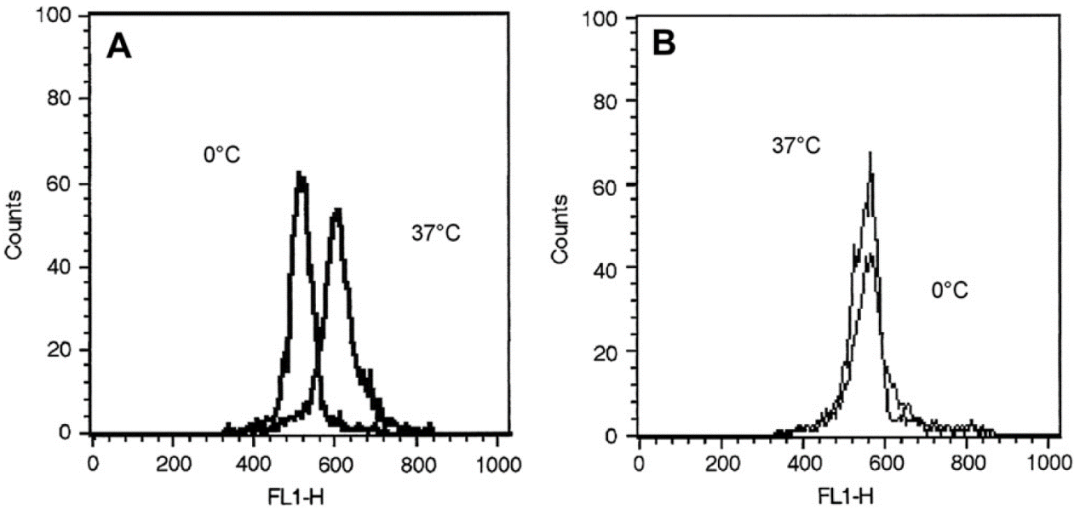
图5 从阳性选择单核细胞生成的树突状细胞(Mo-DC)的内吞能力,(A)来自MACS技术阳选单核细胞的Mo-DC能够吞噬FITC-dextran,符合未成熟DC的特征,(B)来自无柱式技术阳选单核细胞的Mo-DC与本底无差异,提示细胞活化[3]。
实至名归,真正untouched
阴性分离(Negative Isolation)通过磁珠标记进而去除所有非目的细胞,乍一看,阴性分离时磁珠不需要触碰目的细胞,似乎用哪种磁珠都一样,但真的是这样吗?
无柱式分选在阴性分离时仍然需要使用过量磁珠标记非目的细胞,就可能发生磁珠与目的细胞的非特异结合。仅仅由于磁场梯度低,结合了少量磁珠的目的细胞不会滞留在磁场中,但是这种非特异结合仍然可能影响细胞的活性状态。而MACS技术只需要最少量磁珠标记,阴性分离时可以有效避免磁珠与目标细胞的非特异性结合,从而得到真正untouched目的细胞。
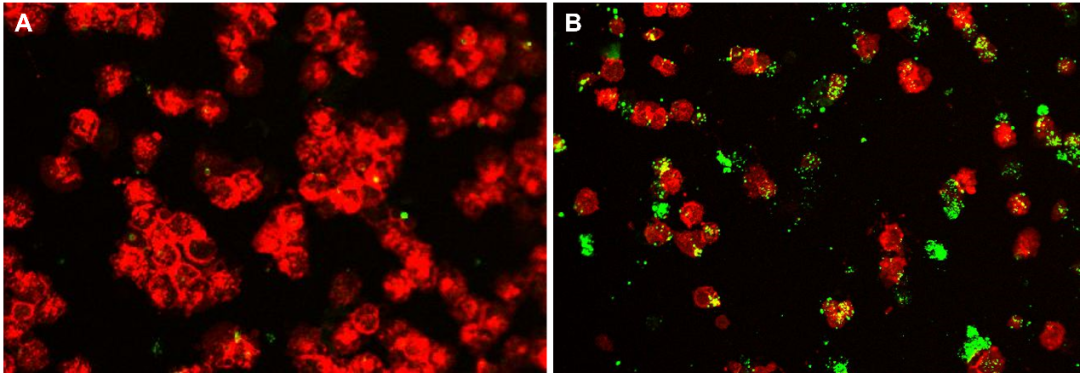
图6 阴性分离的单核细胞用CD14/CD16抗体(红色)和葡聚醣抗体(绿色)进行免疫荧光染色,(A)和(B) 分别用美天旎Monocyte Isolation Kit II human和无柱式分选系统阴性分离。

图7 Western Blotting检测阴性分离的CD4细胞中的JNK1/2 MAPK激活,分别使用MACS技术和3种不同的无柱式分选系统,磷酸化JNK1/2表示MAPK信号通路激活。
因此阴性分离并不是比阳性选择更优的分选策略,而是有不同的应用场景。阴性分离常用于去除不需要的细胞,比如在单细胞测序和类器官等应用中的美天旎“爆款”去死细胞试剂盒,目的细胞是活细胞,通过阴性分离去除样本中的死细胞。需要注意如果希望对含有大量死细胞和细胞碎片的样本直接分选具体类型的细胞,是非常不推荐做阴性分离的,这时目的细胞的纯度会大大降低。另外当目的细胞不适合阳性选择时,比如肿瘤细胞缺乏特异性抗体,或是NK细胞,只用CD56阳性选择,会混有NKT细胞,这时推荐做阴性分离。再就是需要从一份样本分离多种细胞时,可以先进行阴性分离,得到的阴性组分做进一步的磁珠标记和分选。
彩蛋福利
不要你觉得,我要我觉得
做细胞分选大家整天挂在嘴上的就是“高纯度、高得率”,然而究竟多高算高?80%?90%?95%?某些实验就是需要追求极致的纯度或者得率怎么办?分选柱的引入不仅使MACS技术分离的细胞保持了最佳的生物学活性,还为目标细胞群的精细调节预留了空间。对于同一分选磁珠,选择流速较快的LS分选柱还是较慢的LD分选柱,就是在选择纯度还是得率更优先。而在全自动细胞分选仪autoMACS® NEO上,这种调节变得更为简化,也更为精确,使用通用的autoMACS分选柱,调节流速即可实现纯度、得率、速度尽在掌握。
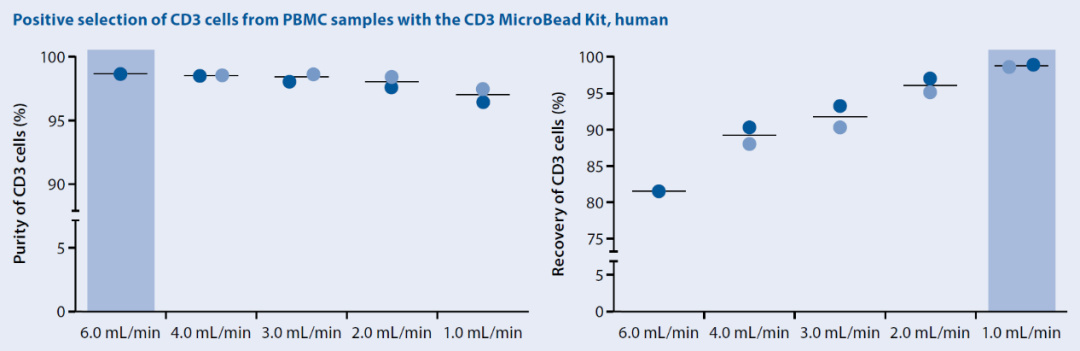
图8 在autoMACS NEO全自动细胞分选仪上使用人CD3 MicroBead Kit阳性选择CD3细胞,不同流速下的细胞纯度和得率。
MACS Cell Separation
敲黑板
划重点
• MACS技术通过分选柱和50nm磁珠实现最少量标记;
• 无论是阳性选择还是阴性分离,都有效保护细胞的活性和功能,兼容各种下游应用;
• 更可以改变流速实现纯度和得率的极致掌控。
来源于优宁维药物研发官网

