最近,Lonza全球技术专家Allen L.Burgenson在《欧洲制药杂志》(European Pharmaceutical Manufacturer)就重组C因子方法发布了最新文章《Recombinant Factor C: a straightforward switch to valid, sustainable QC testing》。
我们都知道,细菌内毒素检测是注射药品和植入式医疗器械产品上市前的一项必要安全性测试。在现阶段,实验室进行细菌内毒素测试的首选仍是依赖动物源的传统鲎试剂方法。随着医药市场的快速扩张,每年的内毒素检测数量持续增长,而鲎资源非常有限。文章中提到,2022年至2029年间,全球LAL检测市场将以每年9%的速度增长。因此,行业一直寻求更可持续的细菌内毒素检测方法。
可持续的质量控制方法
重组C因子(rFC)是一种可持续的替代选择,于2003年开发并商业化。该产品使用重组形式的因子C,内毒素激活重组因子C蛋白,然后裂解荧光底物产生荧光信号。与传统的基于LAL的测定相比,rFC测定具有以下优点:
内毒素检测特异性,重组技术消除了鲎试剂中β-1,3-葡聚糖导致的假阳性结果的干扰
不依赖动物源性成分,提供更高的供应安全性
重组表达生产,产品批间一致性良好
终点荧光测定,不易受到干扰
灵敏度范围从0.005到5EU/ml
消除了对动物源试剂的依赖,符合3R的替代原则
成熟的替代方法
rFC已经是一种成熟的替代方案。将rFC与传统LAL方法进行比较的早期研究,已于2010年初发表在《药典论坛》上。在10种不同的药物产品中,研究人员将rFC与动态显色法LAL进行了比较。根据USP <1225>方法验证章节中的要求,研究人员评估了特异性、精密度、准确度、线性度、定量限和范围。该研究结果表明,rFC与基于LAL的方法相当,是一种适用于测试产品的BET测定方法。
2021年,龙沙研究人员也进行了另一项比较研究,这次研究的是内源性内毒素污染。研究人员在四种非肠道产品中加标内源性内毒素,然后使用LAL和rFC方法测试产品。结果表明,在不同的产品基质中,rFC可与基于LAL的方法相比较。
不少地区国家法规也支持rFC测定,根据若干药典,rFC测定是药典或替代方法。
|
地区 |
法规状态 |
|
|
欧洲药典 |
药典方法(2.6.32章节于2021年生效) |
|
|
中国药典 |
替代方法 |
|
|
美国药典 |
替代方法(rFC章节正在起草中) |
|
|
日本药典 |
替代方法(rFC章节正在起草中) |
|
除了得到众多研究和法规的支持外,rFC测试已经并将继续被广泛使用。礼来的Emgality是2018年FDA批准的首个使用rFC的药物。从那时起,世界各地的监管机构批准了许多其他使用rFC测试的药物。
验证时间表
目前,rFC在美国和中国还不是药典方法,意味着实验室必须对其进行验证,以用于全球分销的产品。假设实验室已经为其产品验证了基于LAL的定量方法,QC人员可以在五天内验证rFC。验证过程与基于LAL的方法相同,只增加了一个步骤——“替代方法验证”。整个验证过程比实验室预想的要容易得多。
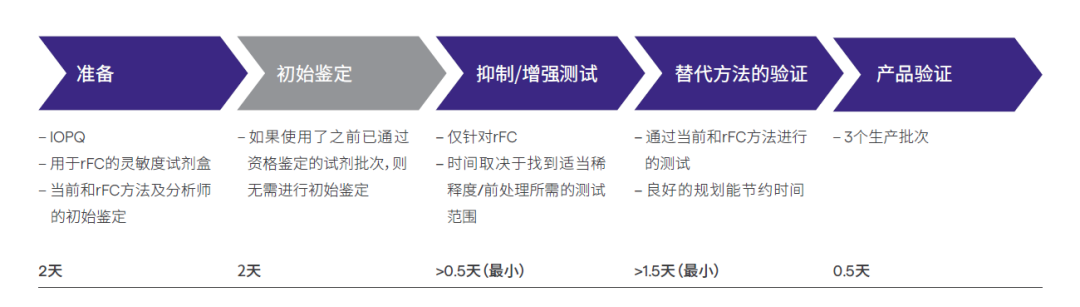
rFC是一种可持续的替代选择,与基于LAL的方法等效,为QC实验室提供了许多优势。最重要的是,从基于LAL的方法过渡到rFC,比QC人员通常认为的可能更容易。BET产品供应商提供的解决方案可以进一步简化流程。例如,为rFC产品提供完整、简单、易于执行的验证方案;同时提供能够在单个仪器中容纳多种测试类型(包括rFC)的酶标仪,这意味着实验室人员可以在评估传统方法和替代方法时直接比较结果,从而在验证过程中节省时间和空间。此外,内毒素检测和分析软件可适用于多种BET方法,包括rFC。
来源于优宁维药物研发官网

