
通过ROS响应纳米颗粒-伊利司莫-铜诱导铜死亡和偶联αPD-L1治疗增强癌症免疫治疗
背景部分介绍:
铜死亡是近两年来细胞死亡领域比较活跃的一个方向,鉴于对铜死亡研究的深入,对于其诱导细胞死亡的机制也越来越清晰。针对铜死亡治疗癌症的研究及药物也在出现。今天来介绍一篇由协和医院的老师和同学发表的一篇相关文章。
cuprotosis是一种新的细胞死亡方式,它依赖于铜离子载体将铜转运到癌细胞中,从而导致细胞死亡。然而,现有的铜离子载体是小分子,血液半衰期短,很难将足够的铜运输到癌细胞中。本文设计了一种活性氧(ROS)敏感聚合物(PHPM),用于将伊利司莫(ES)和铜共包裹形成纳米颗粒(NP@ESCu)。ES和Cu在进入癌细胞后,被过量的细胞内ROS触发,很容易释放。ES和Cu协同工作,不仅通过铜死亡杀死癌细胞,还能诱导免疫反应。在体外,研究了NP@ESCu有效运输铜和诱导铜死亡的能力。
此外,通过RNASeq研究NP@ESCu处理的癌细胞转录组的变化。在体内,研究发现NP@ESCu可诱导皮下膀胱癌小鼠模型的cuprotosis,从而对肿瘤微环境进行重编程。此外,NP@ESCu还与αPD-L1的结合。本研究首次报道了将诱导铜死亡的纳米药物与αPD-L1联合用于强化癌症治疗,从而为未来的癌症治疗提供了一种新的策略。
主要结果部分
❖
NP@ESCu载体的相关设计及在肿瘤部位靶向聚集
❖
NP@ESCu在体外具有抗癌活性
❖
NP@ESCu处理使多种基因上调,且细胞因子-细胞因子受体相互作用途径、内质网蛋白加工途径、PD-1/PD-L1等通路显著富集
❖
NP@ESCu处理可诱导铜死亡
❖
NP@ESCu处理对肿瘤具有显著的抑制作用并对TME产生影响
❖
NP@ESCu偶联αPD-L1在体内的免疫激活及抗肿瘤作用的发挥
结果具体介绍
01
NP@ESCu诱导铜死亡的设计及体内聚集
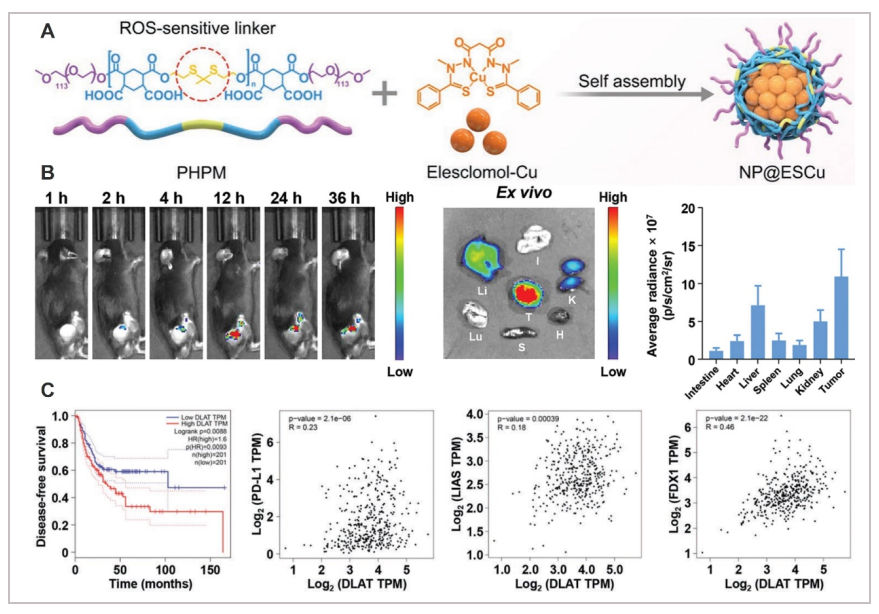
NP@ESCu由三部分组成:PHPM(ROS敏感链接,ROS可以触发PHPM主链中硫酮键的断裂,导致NP@ESCu的解离,并进一步释放被封装的ES和Cu),伊利司莫载体和铜a。小鼠注射cy7.5标记NP@ESCu后的荧光信号(NP@ESCu@Cy7.5)经尾静脉通过体内成像系统仪器监测通过流式细胞术分析,注射后肿瘤部位的荧光强度不断增强,在12 h左右达到峰值。注射后36 h,肿瘤部位仍有较强的荧光信号,说明积累快,保留时间长,荧光信号强度在肿瘤中最强,高于肝、肾、心、肺、脾和肠,说明NP@ESCu@Cy7.5具有较好的肿瘤靶向性B。DLAT、FDX1和LIAS是铜死亡中的关键基因,作者首次利用基因表达谱交互分析(GEPIA)从cancer Genome Atlas数据库中探索膀胱癌患者无病生存与脂酰化DLAT蛋白靶点表达的相关性, 观察发现DLAT低表达比高表达的患者生存期更长,DLAT的表达与PD-L1, FDX1, LIAS的表达正相关C。
02
NP@ESCu的体外抗癌活性
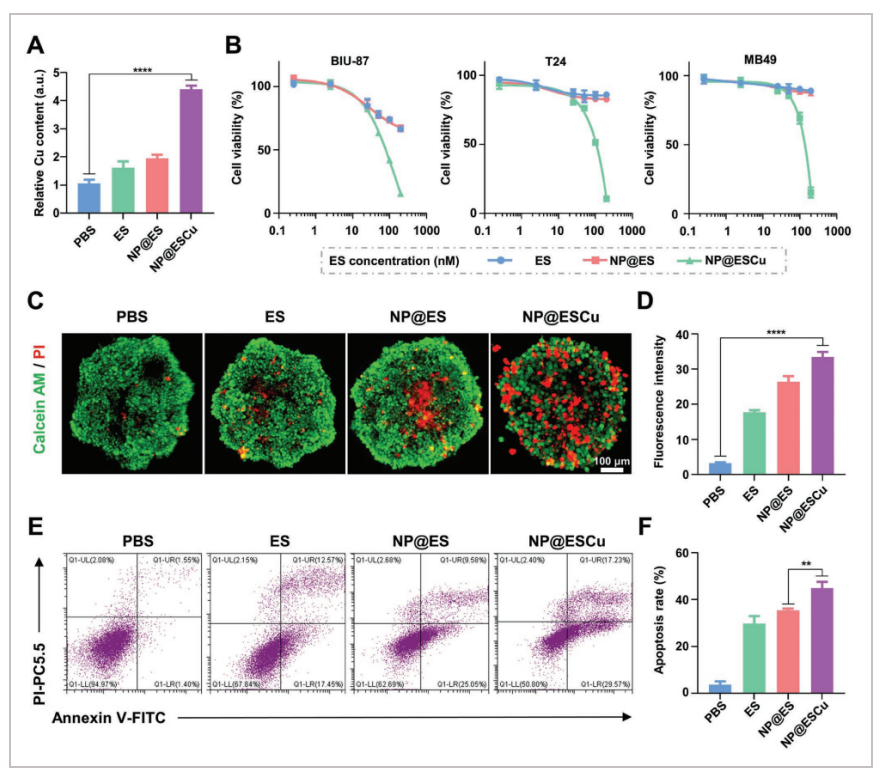
为了检测不同载体对铜的转运效率,作者分别用ES、NP@ES和NP@ESCu处理BIU-87细胞,结果表明,NP@ESCu处理后的BIU-87细胞胞内Cu总量较其它载体显著升高A。随后,通过膀胱癌细胞的MTT实验,探索NP@ESCu的体外抗肿瘤活性,发现NP@ESCu处理能够显著降低三种细胞的活性B。此外,通过三维肿瘤球体活体染色法,目视观察了NP@ESCu的抗癌活性。结果显示,NP@ESCu处理的三维肿瘤球体中死亡细胞(红色)最多C, D。采用Annexin V-FITC和碘化丙啶(PI)双染色法观察不同药物作用下BIU-87细胞的凋亡率,结果表明NP@ESCu处理BIU-87细胞的凋亡率为44.9%,为最高E, F。
03
PBS, NP@ES和NP@ESCu处理的细胞RNA-seq分析
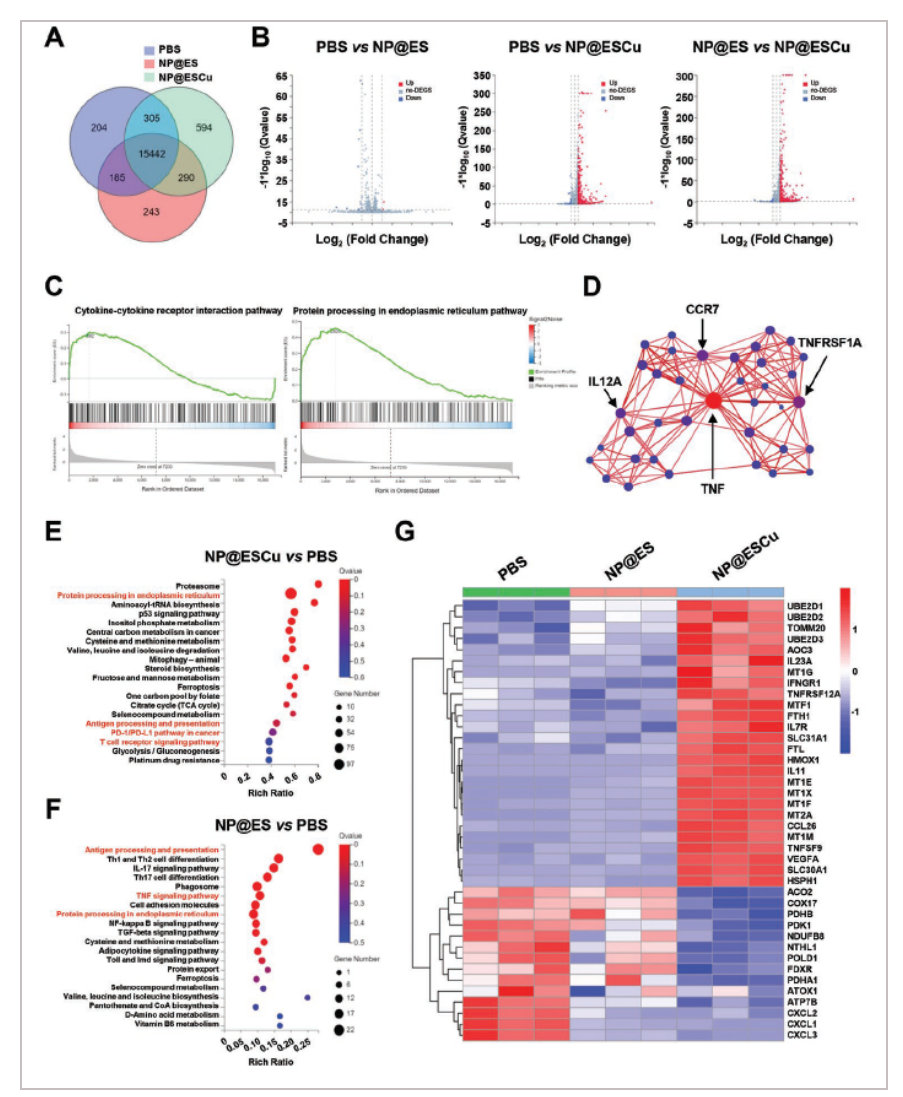
为进一步研究NP@ESCu的作用机制,我们对PBS、NP@ES和NP@ESCu处理过的BIU-87细胞进行了全基因组RNA测序。首次对17263个基因的转录谱进行了研究。其中,243个基因仅在NP@ES处理的细胞中转录,594个基因仅在NP@ESCu处理的细胞中转录A。此外,与PBS处理的细胞相比,NP@ES处理的细胞中有2个基因上调(红点),11个基因下调(蓝点)。然而,在NP@ESCu处理的细胞中,308个基因上调,19个基因下调。此外,与NP@ES处理的细胞相比,NP@ESCu处理的细胞有300个上调基因和10个下调基因B。此外,通过基因集富集分析发现,细胞因子-细胞因子受体相互作用途径和内质网蛋白加工途径在NP@ESCu处理的BIU-87细胞中显著富集C。另构建了蛋白-蛋白相互作用网络D。结果发现,NP@ESCu和NP@ES处理的细胞中,内质网蛋白加工、抗原加工和递呈通路、PD-1/PD-L1通路、T细胞受体信号通路、TNF信号通路和内质网蛋白加工通路均被激活E, F。 尤其在NP@ESCu处理的细胞中,Fe-S簇基因如ACO2和POLD1被下调,而VEGFA基因被上调G。
04
NP@ESCu可诱发铜死亡
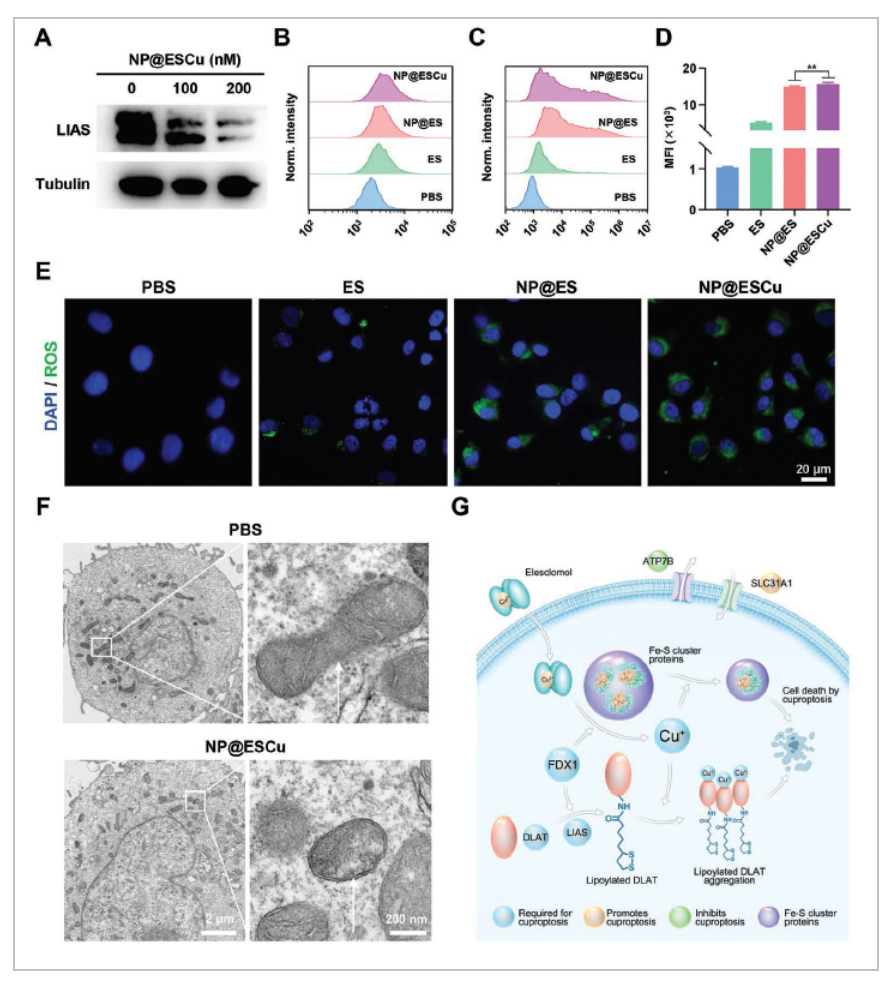
铜离子载体可能导致Fe-S簇蛋白(如LIAS)的下调,LIAS是铜死亡的标志。WB结果表明,LIAS可通过NP@ESCu处理下调,在铜死亡中起关键作用A。随后,用流式细胞术研究不同药物处理的BIU-87细胞中PD-L1的表达。结果NP@ESCu处理的细胞中PD-L1的表达量显著高于PBS、ES和NP@ES处理的细胞B。而针对免疫检查点PD-L1的单克隆抗体,在免疫治疗中经常被用来增强T细胞抗癌活性,因此NP@ESCu联合αPD-L1可能是一种很有前景的癌症治疗形式。研究表明,ES可以在肿瘤细胞中产生ROS,DCFH-DA是一种可在癌细胞中被ROS氧化生成绿色荧光二氯荧光素的探针。结果表明,一方面, NP@ESCu处理的细胞ROS水平最高C, D。 另一方面,CLSM处理NP@ESCu的细胞绿色荧光最强,进一步说明NP@ESCu诱导的ROS最多E。最近的一项研究也表明,依赖线粒体呼吸的癌细胞对铜离子载体的敏感性是依赖糖酵解的细胞的1000倍左右。通过Bio-TEM进一步观察NP@ESCu处理后BIU-87细胞的形态学变化。NP@ESCu可引起癌细胞内严重的线粒体损伤,主要表现为线粒体收缩,膜密度增加,线粒体嵴减少甚至缺失。此外,未见细胞缩回、染色质缩聚或凋亡小体形成F。综上所述,NP@ESCu可上调ROS,诱导线粒体损伤,导致铜体畸形G。
05
NP@ESCu的体内抗肿瘤效果及对TME的影响
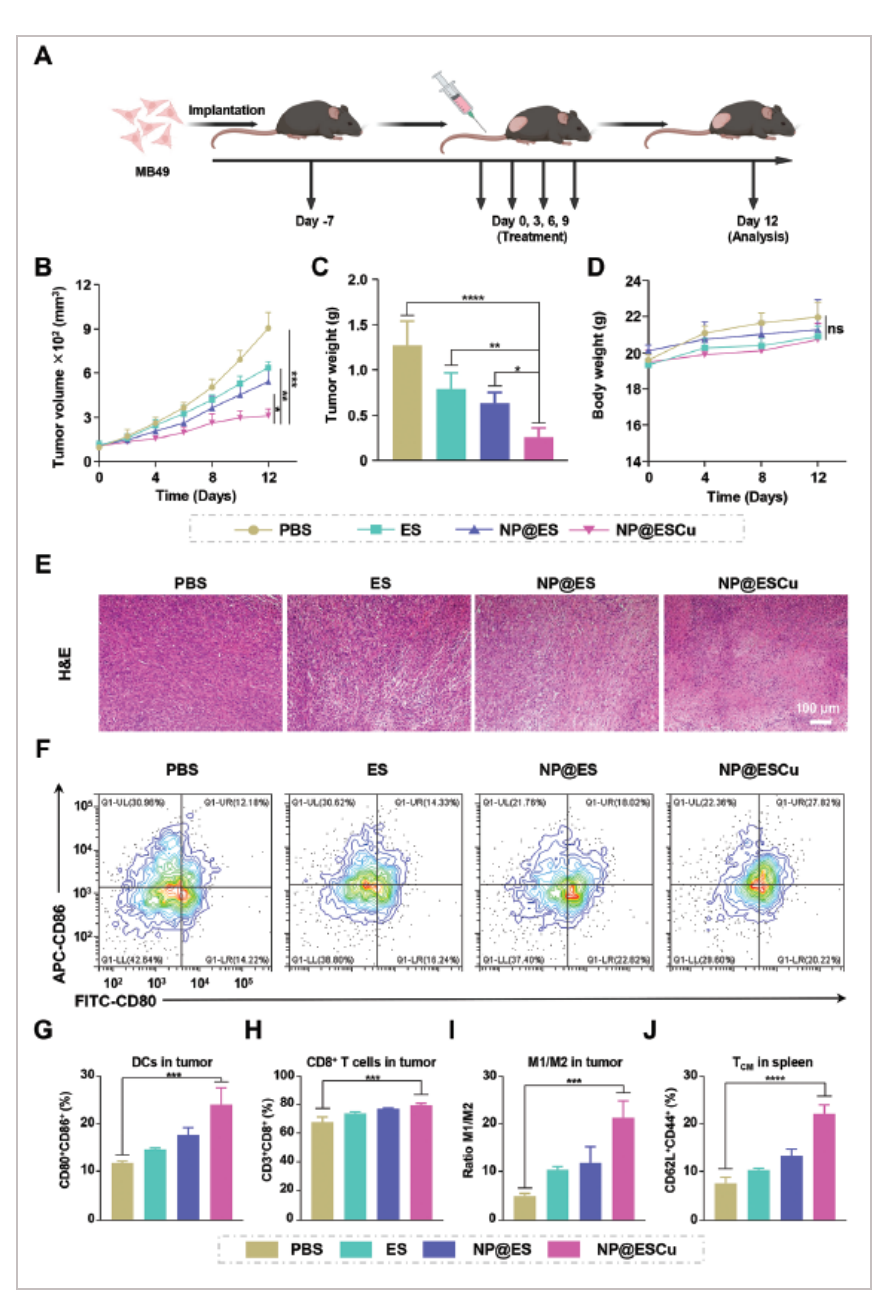
构建基于MB49细胞的皮下肿瘤模型,研究NP@ESCu对肿瘤的抑制作用。PBS、ES、NP@ES、NP@ESCu经尾静脉连续4次给药于荷瘤小鼠A。经检测发现NP@ESCu的抗肿瘤作用最为显著,NP@ESCu处理小鼠的平均肿瘤体积为最小B,肿瘤的重量也最低C。以上结果提示NP@ESCu抗肿瘤效果最优。此外,不同药物处理小鼠的体重发生变化,但体重差异无统计学意义D。H&E染色表明,与其他药物相比,NP@ESCu治疗小鼠的肿瘤细胞出现更广泛的核碎裂和核溶解E。综上所述,这些结果表明NP@ESCu具有最强的肿瘤抑制作用。
为了进一步探讨NP@ESCu对TME的影响,作者收集了不同药物处理小鼠的肿瘤和脾脏进行免疫参数分析。NP@ESCu处理小鼠肿瘤中成熟DC细胞(CD80+CD86+)的百分比最高,说明NP@ESCu能有效促进DCs成熟F,G。CD3+CD8+ T细胞也高于其他药物治疗小鼠H,以及M1/M2细胞比例I,TCM(Central memory)J。
06
NP@ESCu联合αPD-L1在体内的免疫激活及抗肿瘤作用的发挥
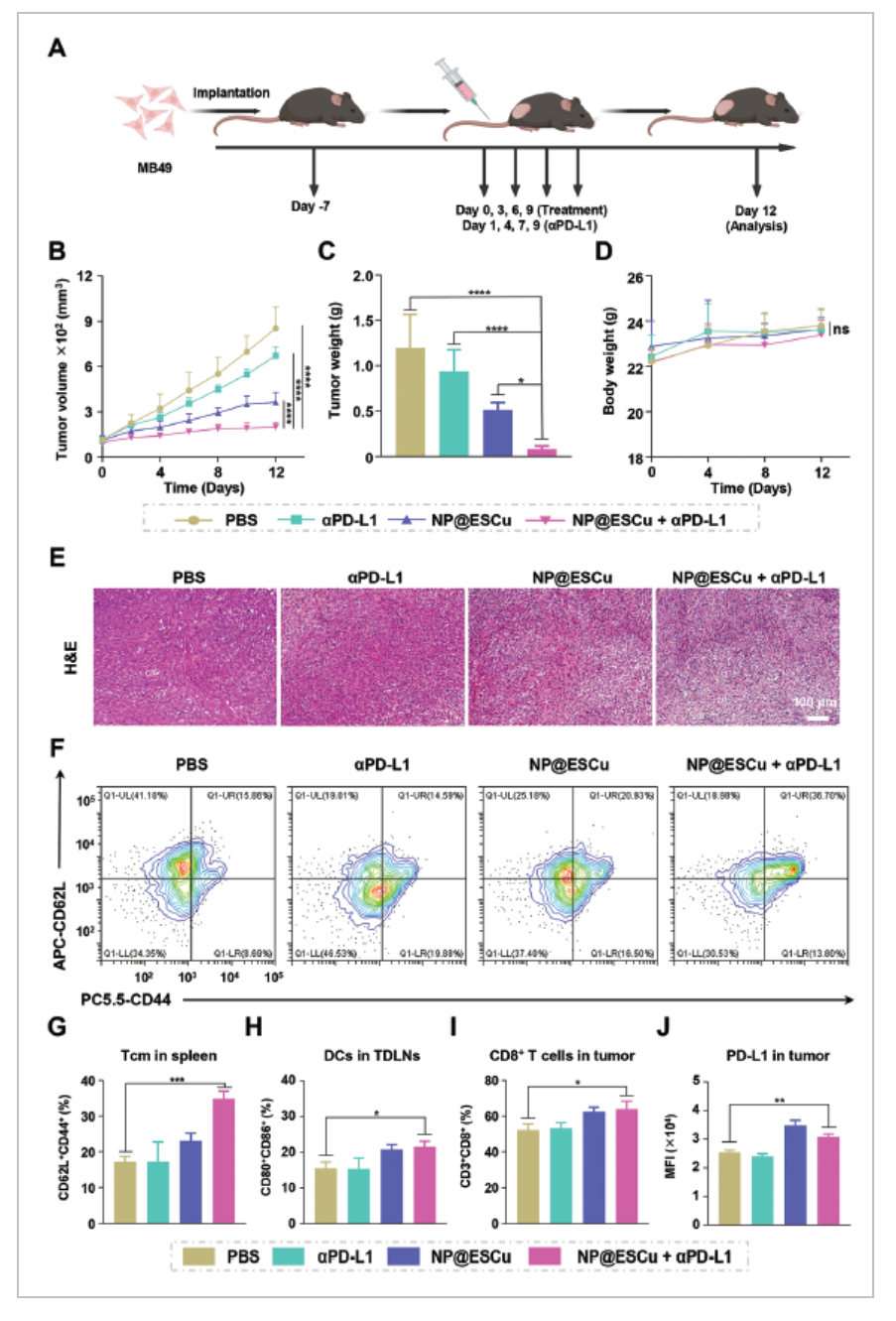
前面的结果已经展示,NP@ESCu处理可提高PD-L1的表达,因此联合抗PD-L1抗体治疗预测会得到更好的治疗结果。验证方法同上一步相似A。结果发现联合治疗,使得肿瘤体积B和重量C减少的幅度最大,在荷瘤小鼠体重无明显差异的情况下D。H&E染色表明,与其他药物相比,NP@ESCu联合αPD-L1治疗小鼠的肿瘤细胞出现更广泛的核碎裂和核溶解E。
对于TME的影响,发现联合治疗组脾中TCM细胞F, G,TDLNs中的DCs H,肿瘤中的T细胞I均较其它组高。另作者还研究了不同药物对小鼠肿瘤组织中PD-L1表达的影响,发现联合治疗组PD-L1显著提高,为PBS组的1.2倍。上述实验结果,进一步证明NP@ESCu + αPD-L1治疗癌症的可行性。综上所述,NP@ESCu + αPD-L1可以重编程TME并触发有效的抗肿瘤免疫应答。
模式图--NP@ESCu联合αPD-L1治疗
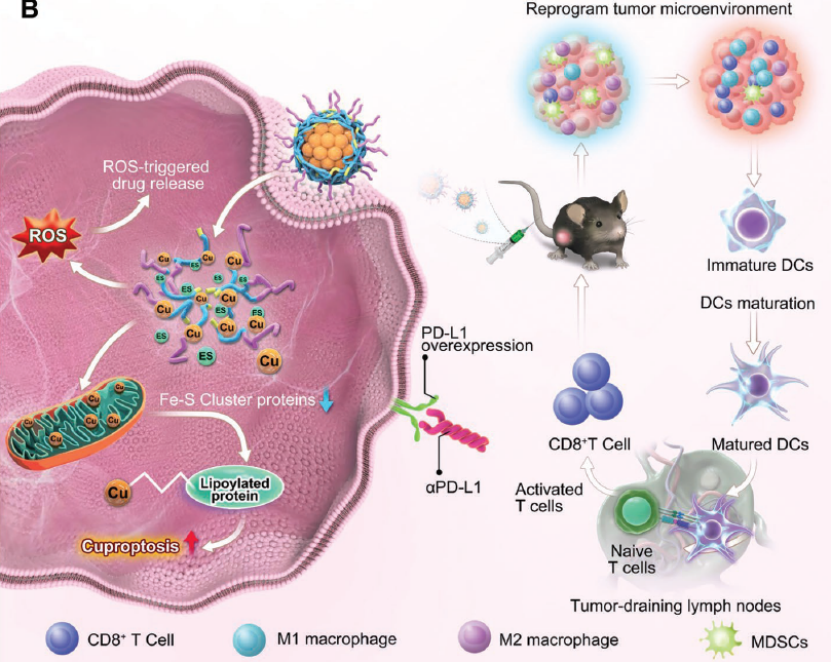
最后,针对文章的研究,作者进行了模式图的绘制。NP@ESCu选择性地积聚在肿瘤部位;肿瘤细胞中过量的ROS触发PHPM的硫酮键迅速断裂,释放被封装的ES和Cu,促进铜死亡;NP@ESCu也促进ROS及PD-L1的释放;NP@ESCu单独及偶联αPD-L1可改变TME,促进免疫。
来源于优宁维药物研发官网

