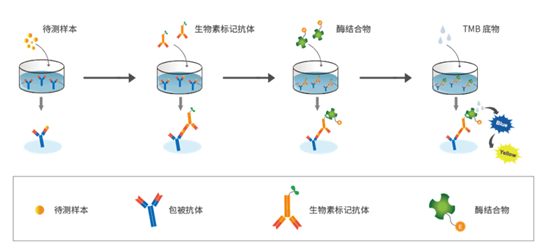
大鼠白介素18(IL-18)ELISA试剂盒(#D731079)采用的是双抗体夹心法酶联免疫吸附检测技术(ELISA),测定样品(大鼠血清、血浆或其他相关生物液体)中大鼠白介素18水平。向预先包被了抗大鼠白介素18抗体的酶标孔中,加入标准品和样本,温育后,加入生物素标记的抗白介素18抗体。再与HRP标记的链霉亲和素结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入显色底物TMB,产生蓝色,并在酸的作用下转化成最终的黄色。最后,在450 nm处测定反应孔样品吸光度(OD)值,样本中的大鼠白介素18浓度与OD值成正比,通过绘制标准曲线计算出样本中大鼠白介素18的浓度。

沉默 TLR4抑制自发性高血压大鼠心房纤维化及 NLRP3-TGF-β 下调对心室颤动的影响
高血压会对心脏造成更大的压力负荷,并可能导致左心房纤维化和扩张,从而导致心力衰竭和心室颤动(AF),房颤(AF)和高血压与心血管疾病风险显著相关,房颤患者中高血压患病率约为60-80%。目前,高血压引起心房纤维化和房颤的特定病理生理机制仍然难以捉摸。
有研究表明,Toll样受体4(TLR4)在高血压下显示上调,TLR4的表达增加与高血压的发生和维持有关。TLR4和核苷酸结合结构域富亮氨酸重复家族含有蛋白结构域3(NLRP3)的蛋白质是先天免疫系统的重要调节因子。为了响应心血管损伤,NLRP3炎性体在 TLR4下游起作用,激活白细胞介素-1β 和 IL-18。转化生长因子β (TGF-β)是一种公认的治疗器官纤维化的靶点。TGF-β可促进胶原和纤维连接蛋白的合成,诱导蛋白酶抑制剂并导致细胞外间质沉积。因此,该研究推测 TLR4的沉默可能通过抑制 NLRP3-TGF-β信号通路来缓解心房纤维化并降低房颤的易感性。此外,高血压相关的心房重构与自发性高血压(SHR)对房颤(AF)的易感性增加有关。本研究的目的是探讨沉默TLR4是否可以下调NLRP3-TGF-β的表达,以抑制SHR的心房纤维化并降低其对AF的易感性。还研究了TLR4沉默对体外培养的心脏成纤维细胞增殖的影响。
原代心脏成纤维细胞的提取和培养
从12只 SD 新生大鼠(1-3天大)中取出心脏,将左心房置于冰上培养皿中,洗涤去除血液和多余组织,然后转移到补充有10% 胎牛血清的培养基中。用剪刀将组织切成小块(1 mm3) ,用磷酸盐缓冲生理盐水(PBS)洗涤,并用0.08% II 型胶原酶和0.25% 胰蛋白酶处理。在37 °C 的培养箱中反应5分钟后,加入0.5 ml 培养基以停止消化,1-2分钟后取上清液并以1000 rpm 离心10分钟。离心后,丢弃上清液,将剩余的细胞在培养箱中的新鲜培养基中培养。用差异粘附法培养90分钟后,丢弃培养基,去除漂浮细胞。细胞传代直至密度达到85-90%。
为了探讨血管紧张素 II (Ang II)对心脏成纤维细胞增殖的影响,用 CCK-8检测细胞增殖情况,测定存活细胞的数量。计数消化的细胞并以5 × 104个细胞/mL 悬浮,然后将100μL/孔接种到96孔板中。24小时后,再饥饿24小时,然后加入 Ang II (0,10-5,10-6,10-7,10-8或10-9 mol/L)。在24小时内,加入 CCK-8溶液(10μL/孔) ,然后将细胞孵育2小时。使用微板读数器测量每个孔在450nm 处的吸光度。
细胞以5 × 104/mL 的密度接种于六孔板中。将用于原代心脏成纤维细胞的培养基用无血清 DMEM (Dulbecco’s 改良 Eagle’s 培养基) 取代,使其饥饿12小时。将细胞分为4组: 对照,Ang II,Ang II + 载体和 Ang II + TLR 4-shRNA。用 shRNA 阴性对照(媒介物)和 TLR4-shRNA (108TU/mL 和感染多样性 = 50)转染 Ang II + 媒介物和 Ang II + TLR4-shRNA。然后,将 Ang II,Ang II + 载体,Ang II + TLR 4-shRNA 组中的细胞饥饿24小时,然后用10-6mol/L Ang II 刺激24小时。
提取来自左心房组织和成纤维细胞的总 RNA,进行定量实时 PCR。
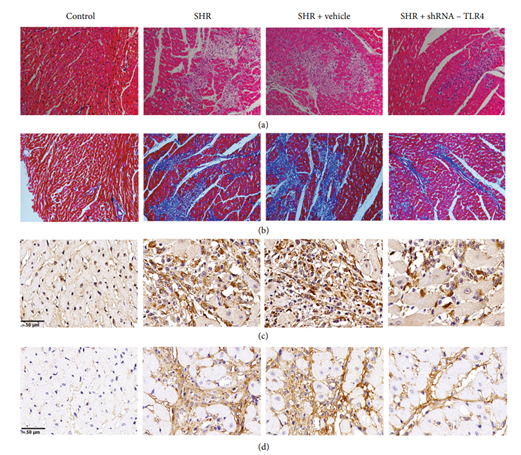
图2. 大鼠左心房组织切片染色图[1]
TLR4的沉默减轻了心房纤维化
Western Blot
使用 RIPA 裂解缓冲液从左心房组织和心房成纤维细胞中提取总蛋白。用 BCA 蛋白测定试剂盒测定蛋白质浓度。蛋白质(25μg)通过10% SDS-PAGE在70V 下分离1小时,然后以220mA 转移到 PVDF 膜上2小时。在室温下,用5% 脱脂奶粉在 TBST 缓冲液中封闭细胞膜1小时。将印迹与靶向 TLR4(1:1000) ,NLRP3(稀释1:250) ,pro-caspase-1(稀释1:1000) ,caspase-1-p20(稀释1:1000) ,TGF-β(1:1000稀释),IL-1β (1:1000稀释) ,IL-18(1:1000稀释) ,胶原蛋白 I (1:2000)或 GAPDH (1:2000)。然后用 TBST 洗涤膜三次,并与相应的二抗在室温下孵育1小时。GAPDH 作为内部对照。蛋白质印迹带通过酶化学发光(ECL)试剂盒成像,并使用 ImageJ 软件进行定量。
Enzyme-Linked Immunosorbent Assay (ELISA)
用酶联免疫吸附测定法(ELISA)测定细胞培养上清液中 IL-1β 和 IL-18的酶联免疫吸附试验。根据制造商对大鼠 IL-1β (Sangon Biotech,D731007,中国上海)和 IL-18(Sangon Biotech,D731079) ELISA 试剂盒的说明,将标准品和样品加入到已经用抗大鼠 IL-1β 和 IL-18抗体预包被的微板中。温育后,将生物素化的抗大鼠 IL-1β 和 IL-18抗体加入到微孔板中,并与 HRP 缀合的链霉亲和素结合形成免疫复合物,然后洗涤五次以除去未结合的酶。加入显色底物以产生蓝色,然后用酸将其转化为最终的黄色。最后,在450 nm处测量吸光度(OD)。血清中 IL-1β 和 IL-18浓度与 OD 呈正相关。
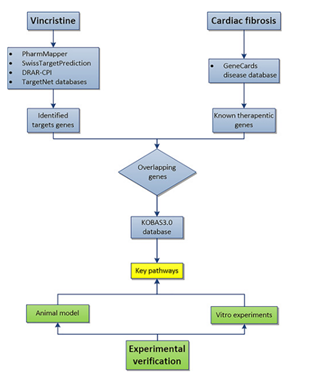
在另一篇作者探究氨磺必利对慢性应激抑郁大鼠的改善作用研究[2]时,也用D731079(大鼠白介素18(IL-18)ELISA试剂盒)检测海马组织中 IL-6、IL-1β、IL-18 水平;此外,用此试剂盒检测的IL-1β和IL-18的水平,用来探究长春新碱(VCR)通过抑制NLRP3炎症小体激活来减轻心脏纤维化[3],下图是此实验的工作流程,绿色实验验证部分同样用到了WB实验和ELISA实验,感兴趣的同学可参看原文~
NLRP3炎性体是先天免疫系统的重要组成部分,NLRP3炎性体位于TLR4的下游。有研究表明抑制 TLR4可导致抑制 NLRP3炎症小体介导的炎症反应。TGF-β 被认为是与炎症和组织损伤相关的纤维化的主要介质,并且可以在纤维化疾病中受到 NLRP3的调节。沉默 TLR4抑制 NLRP3炎症小体的活化和 TGF-β的表达,导致心房纤维化减少和体内 AF 易感性和体外 CF增殖。该研究探讨了一种可能的机制(如下图),表明TLR4的下调抑制了NLRP3炎症小体的激活,导致IL-1β、IL-18和TGF-β水平降低,减轻了SHR的心房纤维化和对AF的易感性。此外,该研究发现在体外沉默TLR4可以抑制NLRP3炎症小体和心脏成纤维细胞(CF)的增殖。
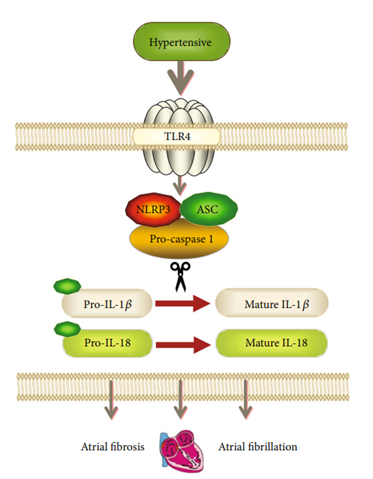
图4. 研究机制示意图[1]
来源于生工生物官网

