神经胶质母细胞瘤(Glioblastoma,GBM)是常见的颅内原发性肿瘤,呈侵袭性生长,临床治疗效果不佳,手术后易复发,预后差,平均生存期仅为15-18个月,是神经外科治疗中最为棘手的难治性肿瘤之一。近年来,对于各种类型肿瘤的免疫疗法取得了长足进展,然而对于GBM的治疗却差强人意。因此,建立稳定的和一致性的神经胶质瘤小鼠模型以及原位投递治疗药物的实验方案,对于克服因血脑屏障造成的实验误差,准确评价候选免疫药物对胶质瘤的治疗效果,具有重要的临床意义。该方案展示了一种优化的小鼠神经胶质瘤造模策略与步骤,通过事先在小鼠头骨合适位置准确植入专用螺丝(screw guide),结合经过改进的配套微量注射平台,可将待研究的GBM细胞同时注入多达10只小鼠脑部,从而可以稳定而快速地建立具有GBM及其肿瘤免疫微环境的动物研究模型。同时,该论文提出并优化了重复原位给予治疗药物以及后继免疫评估的整体方案。基于该造模方法,胡宝利课题组已发表多篇研究论文,包括Cell、Cancer Cell、Cancer Discoverry、Journal of Clinical Investigation等[1-4],助力GBM肿瘤生物学及其免疫治疗的发展。

研究者详细阐述了利用文章中方案的实验器材、GBM造模的实验步骤及注意事项。与常规的单个小鼠颅内GBM造模方法相比,该方法能够对至少十只小鼠同时造模,大大节省了实验时间,减少了实验人员的工作量(图1)。此外,由于同时植入细胞,减少了因实验操作造成的组内及组间差异,提高了实验准确率。
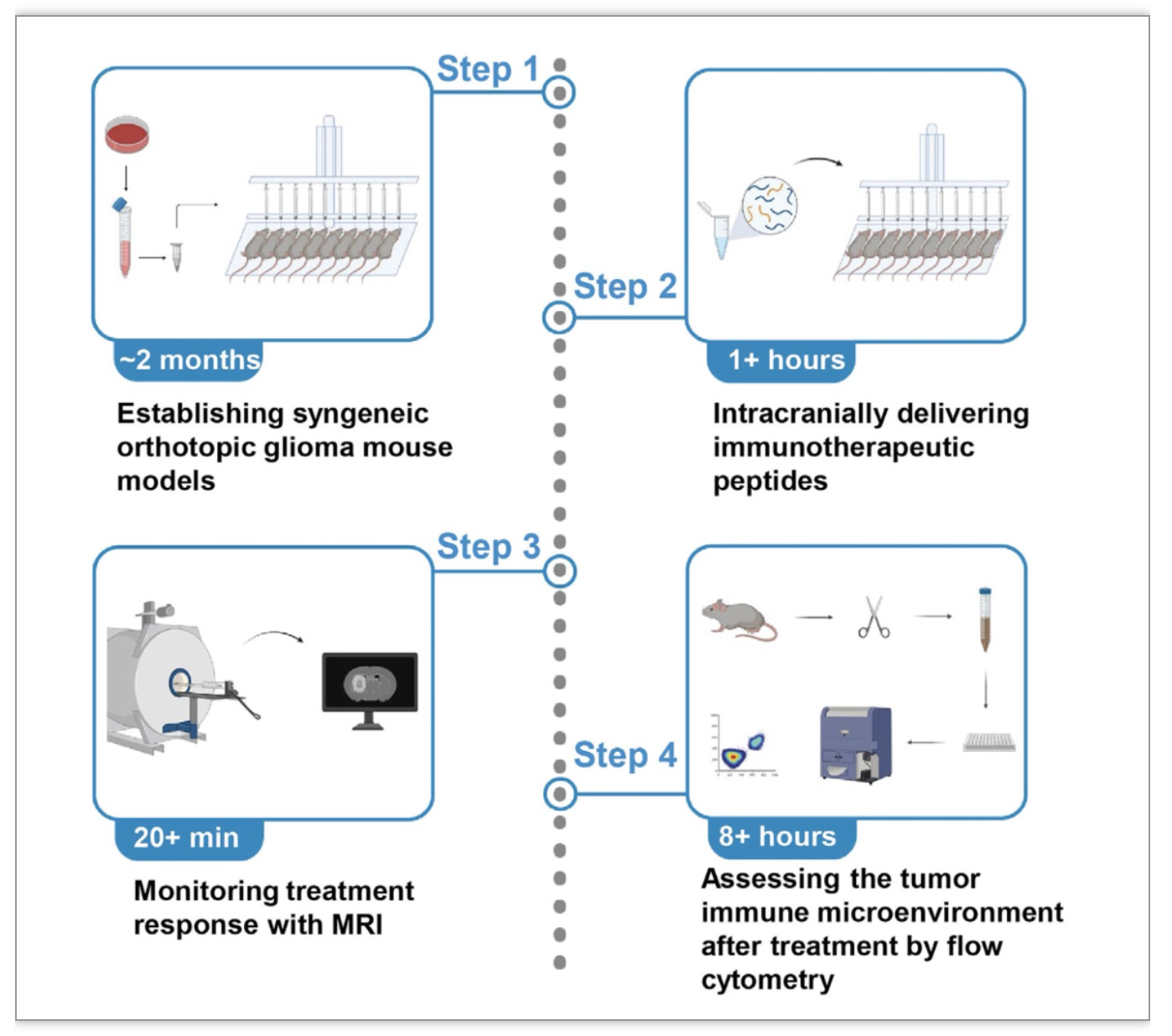
图1 建立神经胶质瘤小鼠模型以及原位投递治疗药物的实验方案
(图源:Chen A et al., STAR Protoc, 2023)
除了造模外,该方案也提供了利用同一设备进行颅内肿瘤药物多次原位投递的实验方法及利用核磁共振(MRI)监测肿瘤治疗效果的评估(图2A、B)。随后,研究者分析了经过多肽多次原位干预后GBM小鼠肿瘤微环境中免疫细胞的变化(图2C、D)。方案中提供了GBM小鼠模型中脑和脾脏的处理和分离方法,以及后继组织中用于流式细胞技术分析免疫细胞群落的细胞制备和染色的详细步骤。由于小鼠个体的差异,每只小鼠的实验终点及样品处理时间不尽相同。为了减少工作量及流式分析的批次差异,方案采用了细胞分离、冻存液分别冻存、最后细胞复苏统一染色进行流式分析的模式。该方案可用于广泛分析GBM小鼠模型的肿瘤免疫微环境。同时,论文中组织处理、细胞分离后,也可用于质谱流式的分析[4]。
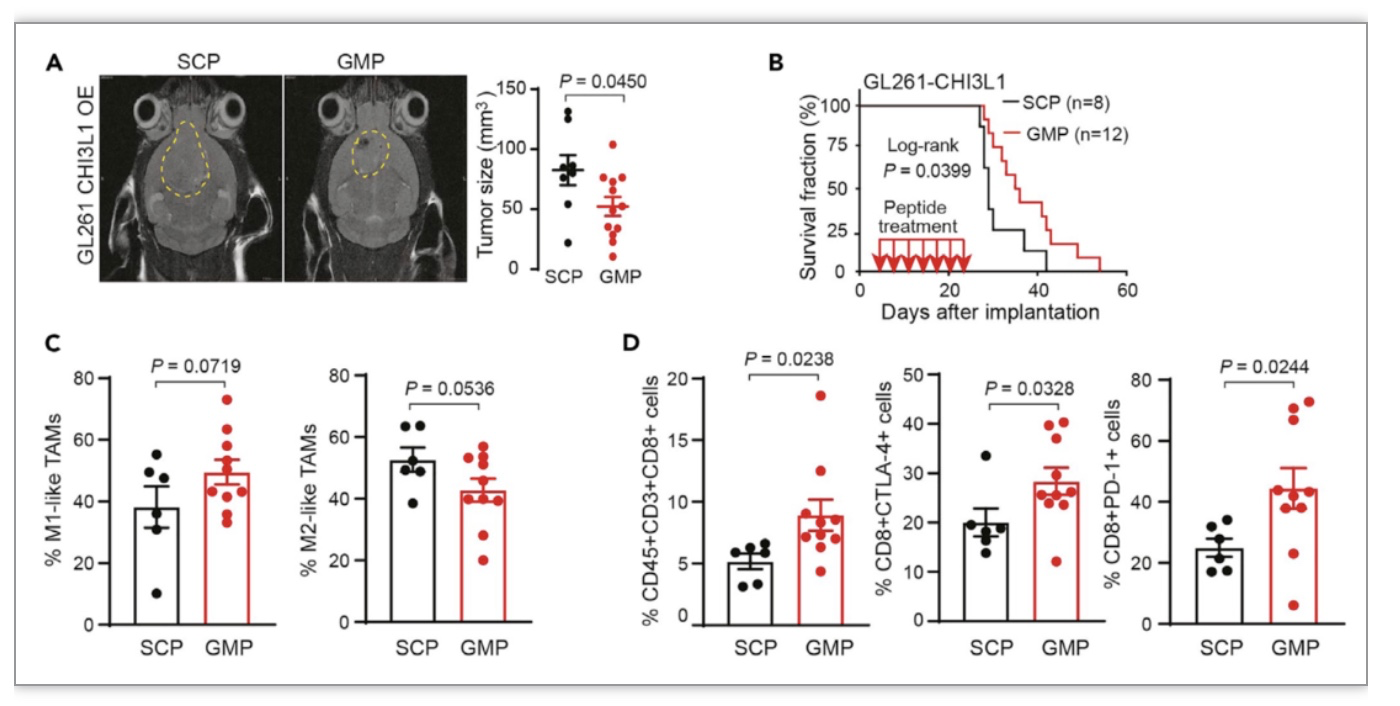
图2 药物原位投递后对神经胶质瘤小鼠模型治疗效果的评价
(图源:Chen A et al., STAR Protoc, 2023)
综上所述,该实验方案系统性介绍了原位GBM动物模型的制备,随后利用同一设备和技术平台对动物颅内GBM多次药物干预后进行效果评估,并进一步分析GBM动物模型中肿瘤免疫微环境的变化。该方法较之常规的GBM造模,可以一次同时对多达十只小鼠颅内植入GBM细胞,减少了实验的时间,工作量,以及仪器和操作导致的组内、组间差异,提高了实验结果的准确率。该方法可普遍用于评价基于GBM动物模型的治疗神经胶质瘤的免疫制剂、小分子药物等的功效。同时,也提供了一种针对动物模型GBM肿瘤免疫微环境的流式分析的标准操作程序。值得注意的是,方法中对脑和脾脏组织的制备进行了优化,如需对GBM模型中的外周血免疫细胞(PBMCs)进行分析,该方案是否最优或者合适,尚需进一步探索。

