基因组步移(Genome-walking)是一种获取未知侧翼DNA的技术,已成为分子生物学及相关领域不可或缺的一部分[1,2]。最早的步移技术基于繁琐的基因组文库构建与筛选;随后逐步发展出了简单、快速且可靠的PCR基方案[3,4]。PCR方法种类繁多,但依据原理总体上可以分为三类:(1)反向PCR;(2)连接介导的PCR;(3)随机引发PCR。前两类技术涉及限制酶切割和连接步骤。随机引发PCR则无需在扩增前对模板进行任何处理,但其步移效率和非特异性背景仍有待改进[5-8]。该方案设计了三条步移引物即腕表引物(Wristwatch primer,WWP),其3’端的12 bp和5’端的3 bp序列一致,而中间10 bp则两两之间完全错配。因此,仅在温度足够低的情况下,一条WWP才能退火至另一WWP的互补序列,并形成一种能选择性地富集侧翼序列的腕表样结构。该方法因此被称为腕表PCR(Wristwatch PCR)。通过调取微生物和水稻已知基因的侧翼序列,验证了方法的可行性。腕表PCR可成为现有基因组步移技术的替代方案。

该研究设计了一套共3条WWP,其特征是每两条WWP之间具有相同的5’端(12bp)和3’端(3bp),以及错配的中心区域(10bp)(表1)。任意两条WWP只能在低温退火,并形成腕表样结构。三条WWP因使用顺序不同,可形成三组不同的引物组合(表2)。在每次步移实验中,三个WWP组合分别与一套巢式特异性引物配对,平行进行三组WW-PCR扩增。每组WW-PCR包括三轮(一级、二级、三级)巢式扩增,分别由该WWP组合顺序配对巢式特异性引物进行。
表1本研究使用的腕表引物
(表源:Wang LQ, et al., STAR Protoc, 2023)

注:WWP是指Wristwatch primer即腕表引物
表2 腕表引物组合及其与特异性引物组的配对
(表源:Wang LQ, et al., STAR Protoc, 2023)
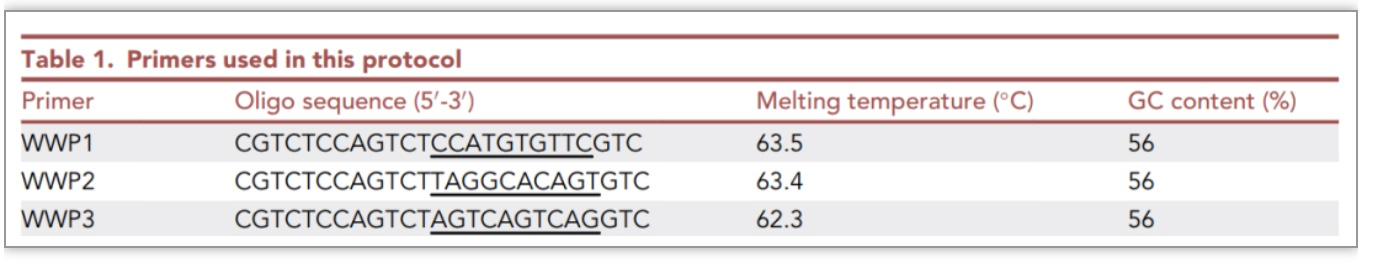
注:WWP是指Wristwatch primer即腕表引物;GSP是指gene-specific primer即基因特异性引物
每轮WWP-PCR执行一个低严谨型循环,以促使WWP在基因组模板上任意退火,或定向退火至前一轮扩增子的WWP位点,从而合成一个单链DNA(ssDNA)池。其中,目标ssDNA的3′末端为特异性引物(GSP)的互补序列,5’末端为WWP序列;在随后的一个高温循环中,GSP退火至其位于3′末端的互补区,延伸得到一条两端分别为完整的GSP和WWP的双链;在剩余的高温循环中,该双链呈指数扩增。非目标ssDNA因不存在任何引物的完整退火位点而不能被扩增。经过三轮巢式PCR,可有效地富集目标产物,同时消除非特异性背景。WWP-PCR的原理和实验步骤如下(图1,2),一般仅需两轮PCR,即可得到目的条带。该方法完全基于PCR扩增,且WWP对任何基因组通用。
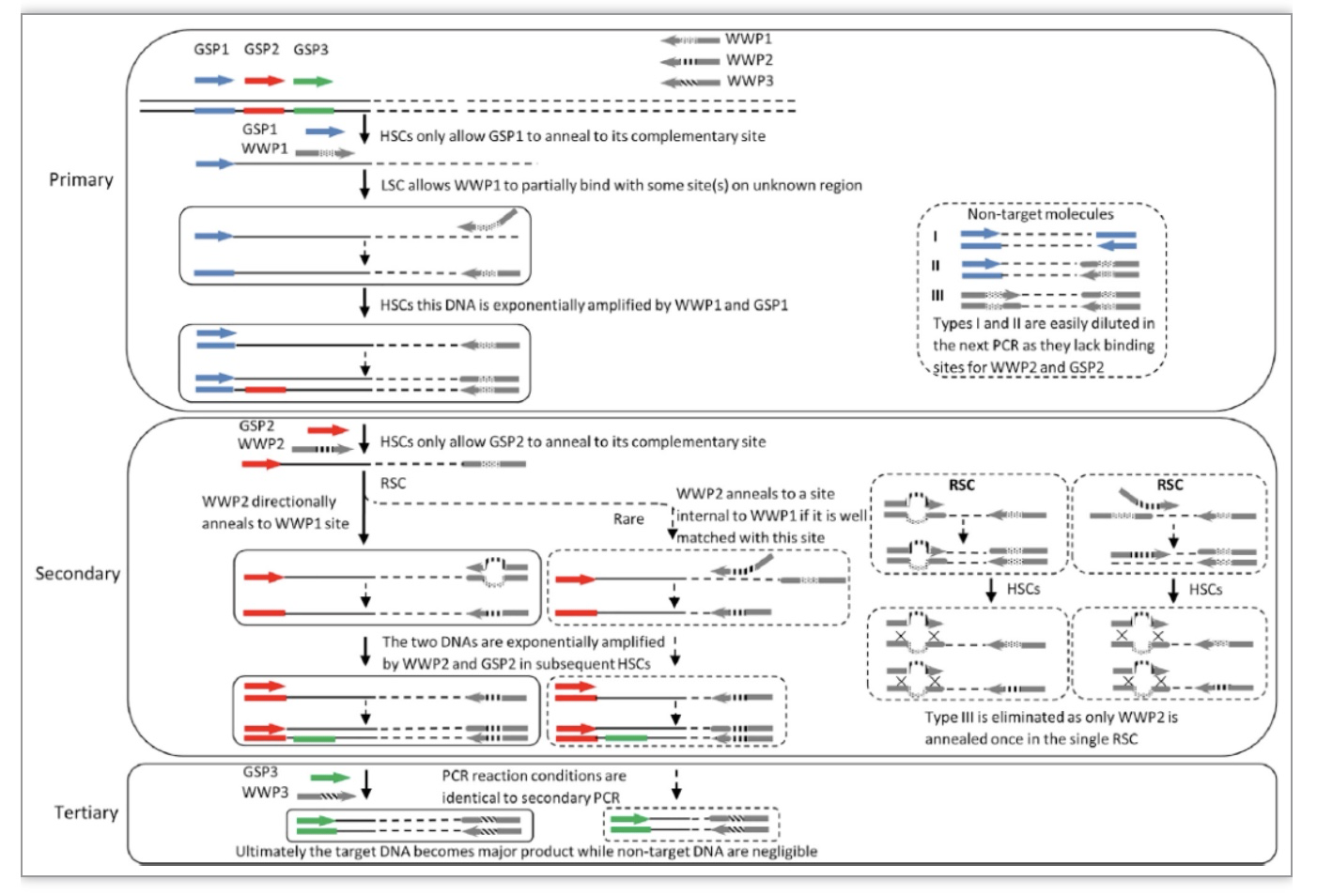
图1 腕表PCR原理图
(图源:Wang LQ, et al., STAR Protoc, 2023)
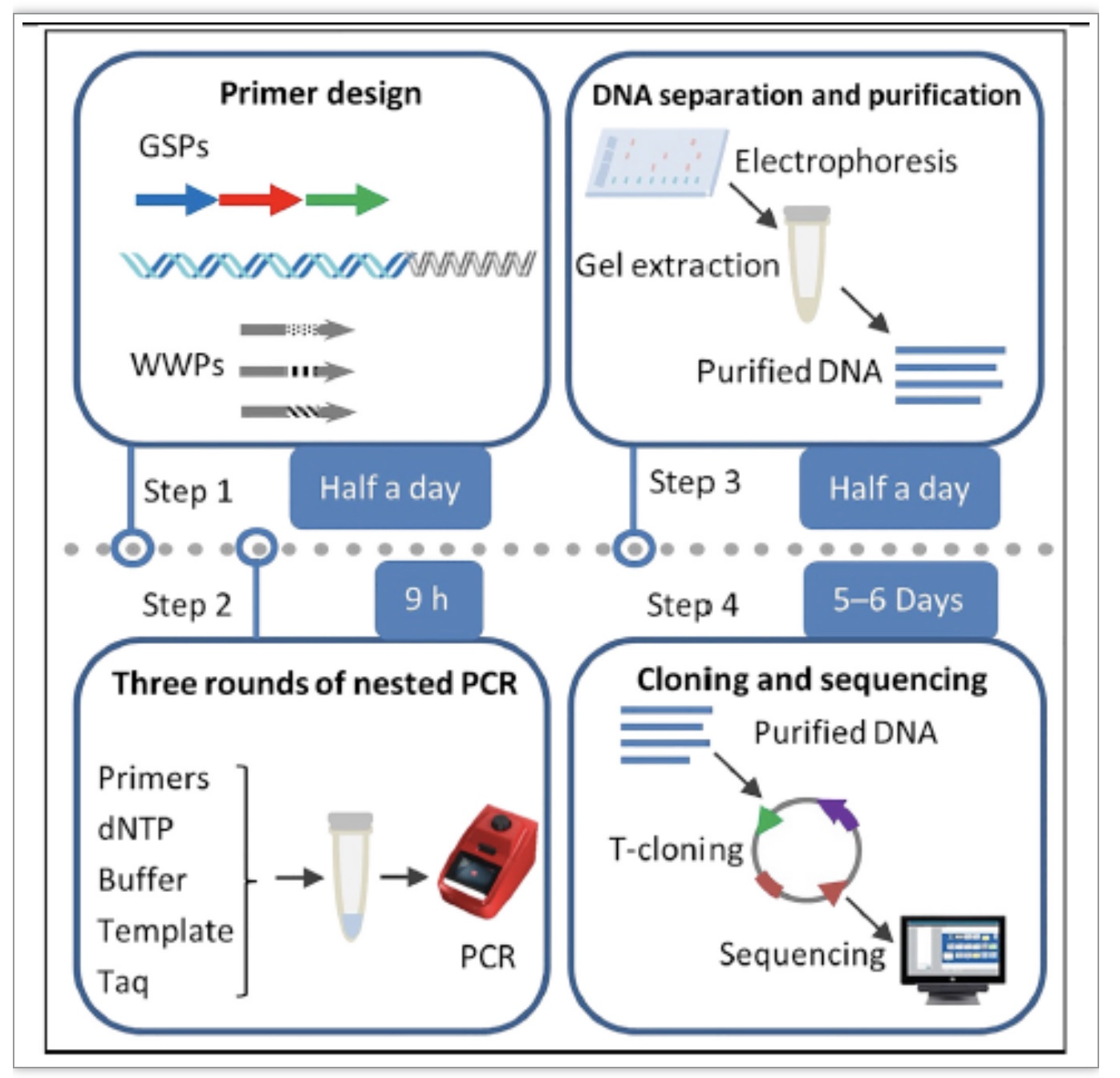
图2 腕表PCR方案流程图
(图源:Wang LQ, et al., STAR Protoc, 2023)
为了验证WW-PCR的可行性,用其分离短乳杆菌谷氨酸脱羧酶基因和水稻潮霉素的侧翼序列。结果表明,每个WW-PCR获得的清晰条带均为目标产物,且每次可步移达4 kb,显示出方法的高特异性和高效率。一些WW-PCR产生了多条DNA带,这是由于初级WWP在低退火循环中部分退火到了未知区域上的多个位点。由于巢式GSP之间的位置关系,二级扩增产物略大于三级产物(图3)。
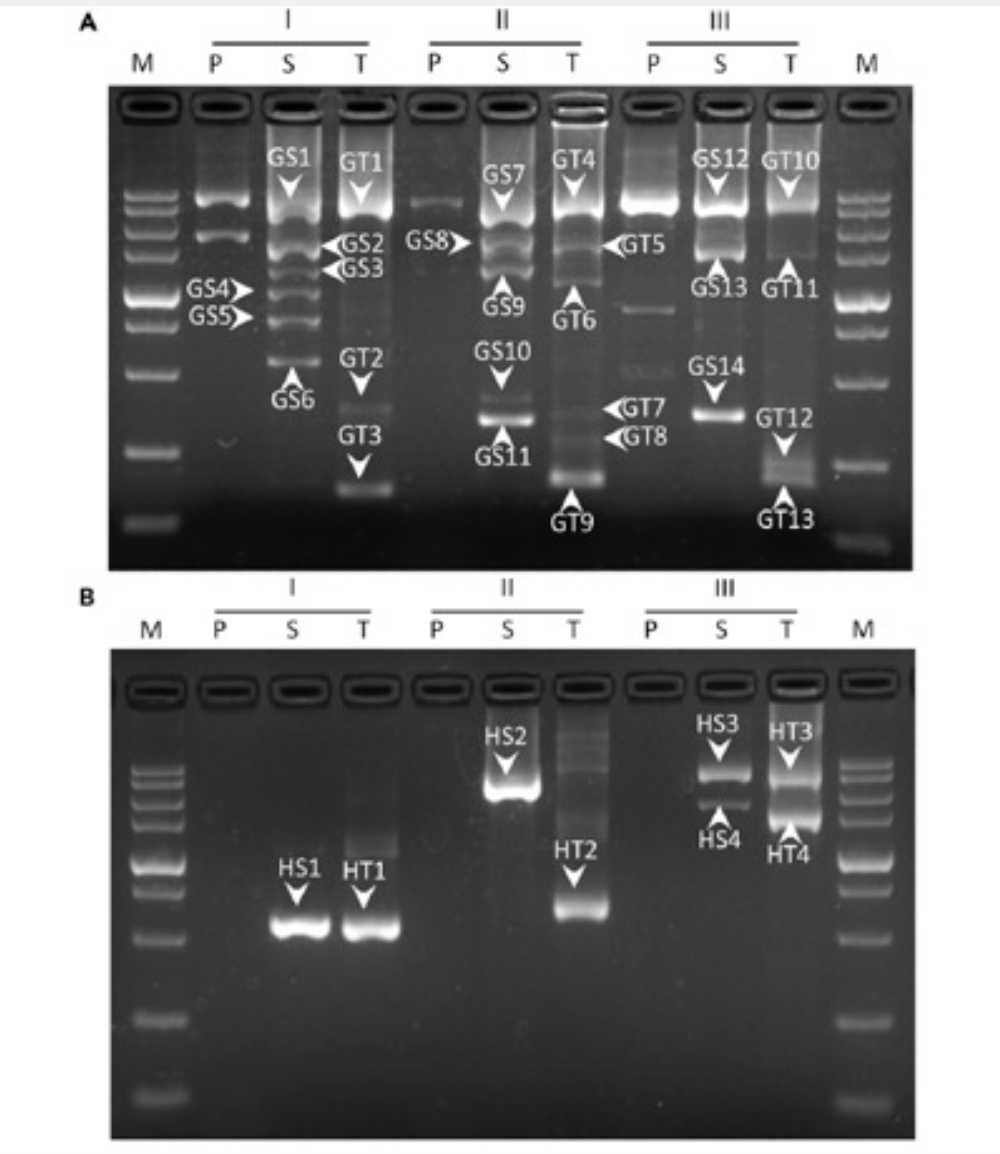
图3 腕表PCR基因组步移验证结果
(图源:Wang LQ, et al., STAR Protoc, 2023)

