二甲双胍是2型糖尿病(T2D)的一线治疗药物。越来越多的证据表明,二甲双胍治疗还有多种益处,包括肥胖患者减重、心肾保护、神经保护、整体健康改善和降低癌症风险等。ClinicalTrials.gov上显示二甲双胍相关的癌症临床试验高达400项。例如,结直肠癌(CRC)是全球最常见的癌症类型之一,前人研究发现T2D患者发展CRC的风险增加了30%,而二甲双胍使用可将T2D患者的CRC风险降低29%,同时减少患者的特异性死亡率[1-2]。磷酸化蛋白质组学是研究复杂信号通路与网络的利器,能否利用磷酸化蛋白质组学技术探究神药二甲双胍的抗癌活性[3]?
这项工作利用基于质谱的磷酸化蛋白质组DIA定量技术(phos- DIA),定量监测了二甲双胍应激(30 min)与长时程(24 h)处理后12种异质性的结直肠癌细胞系中10,142个蛋白质和56,080个磷酸化位点(P-site)的量变信息,结合细胞生物学实验,发现了众多的二甲双胍下游的磷酸化新位点,并初步发现了可能与二甲双胍互作的癌症药物,为理解二甲双胍在在结肠直肠癌细胞中的作用机制提供了高质量数据集与重要线索。

研究首先选取了代表CRC的5个不同临床蛋白质组亚型 (CPS1-CPS5) [4] 的12种细胞系(图1A),并在使用10mM二甲双胍前培养24小时以到达营养消耗状态[3]。此后,分别在加入二甲双胍30分钟和24小时后利用DIA技术深入定量分析蛋白质组还是磷酸化蛋白质组的变化(图1B-D)。主成分分析显示,12种不同CRC细胞株在二甲双胍短期和长期干预后CRC蛋白组表达水平上变化一直很小,但在24小时后磷酸化蛋白组的变化明显,且表现呈高度异质性(图1E),提示二甲双胍对磷酸化信号网络的系统重塑。
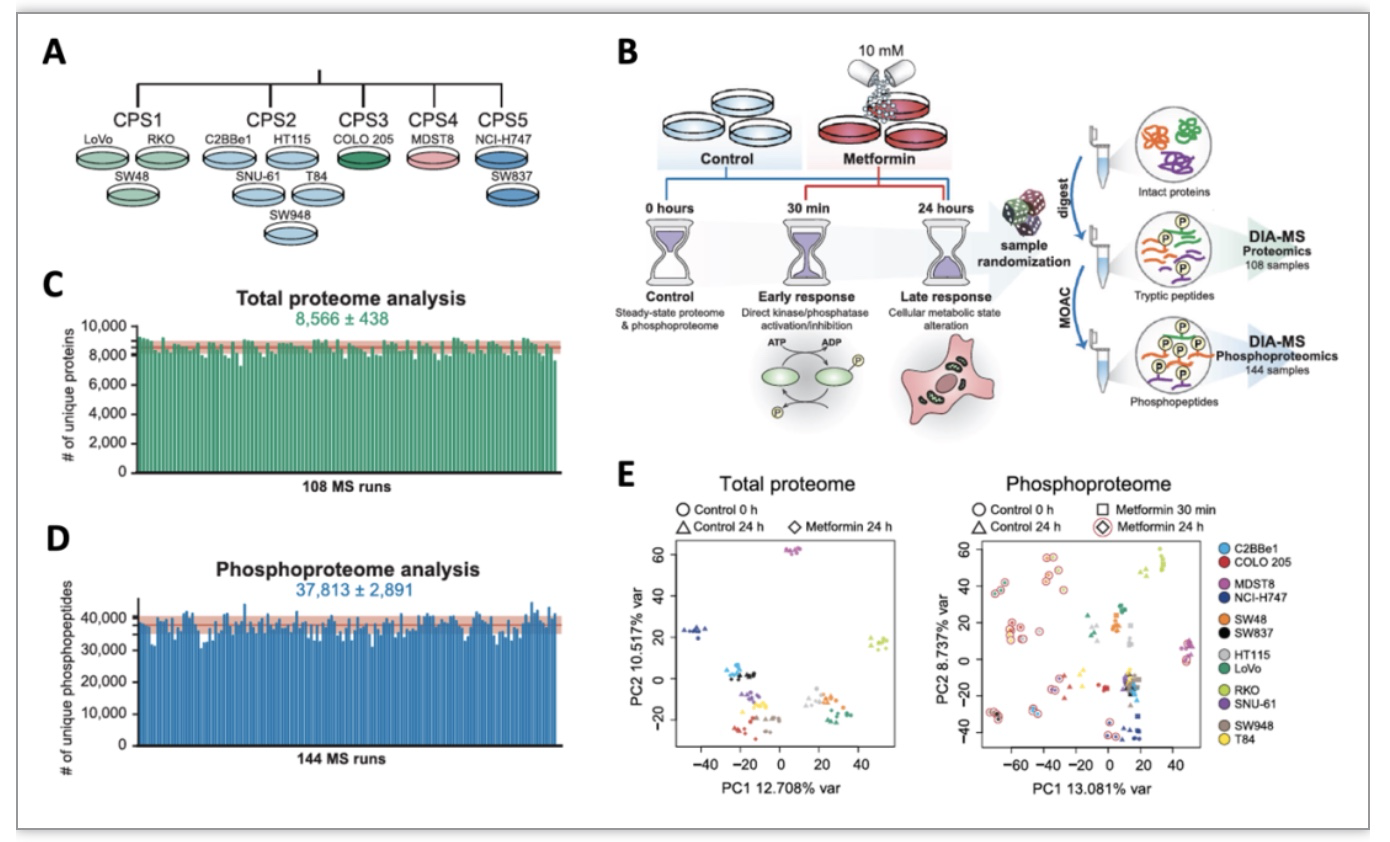
图1 12种结直肠癌细胞中蛋白质组和磷酸化蛋白质组对二甲双胍的响应
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)
研究数据进一步显示,二甲双胍在CRC细胞的长期效果(24h)较短期(30min)变化更明显(图2)。有意思的是,即使在24h的数据中,MDST8和NCI- H747两种细胞的磷酸化蛋白质组仅仅变化了0.8%和4.1%,而另外10种CRC细胞株则有13.8%-41.9%的磷酸化位点发生了显著变化。然而,仅仅有0.08%的磷酸化位点变化被这10种细胞系所共有,强烈提示二甲双胍对CRC磷酸化蛋白质组影响的个体异质性。
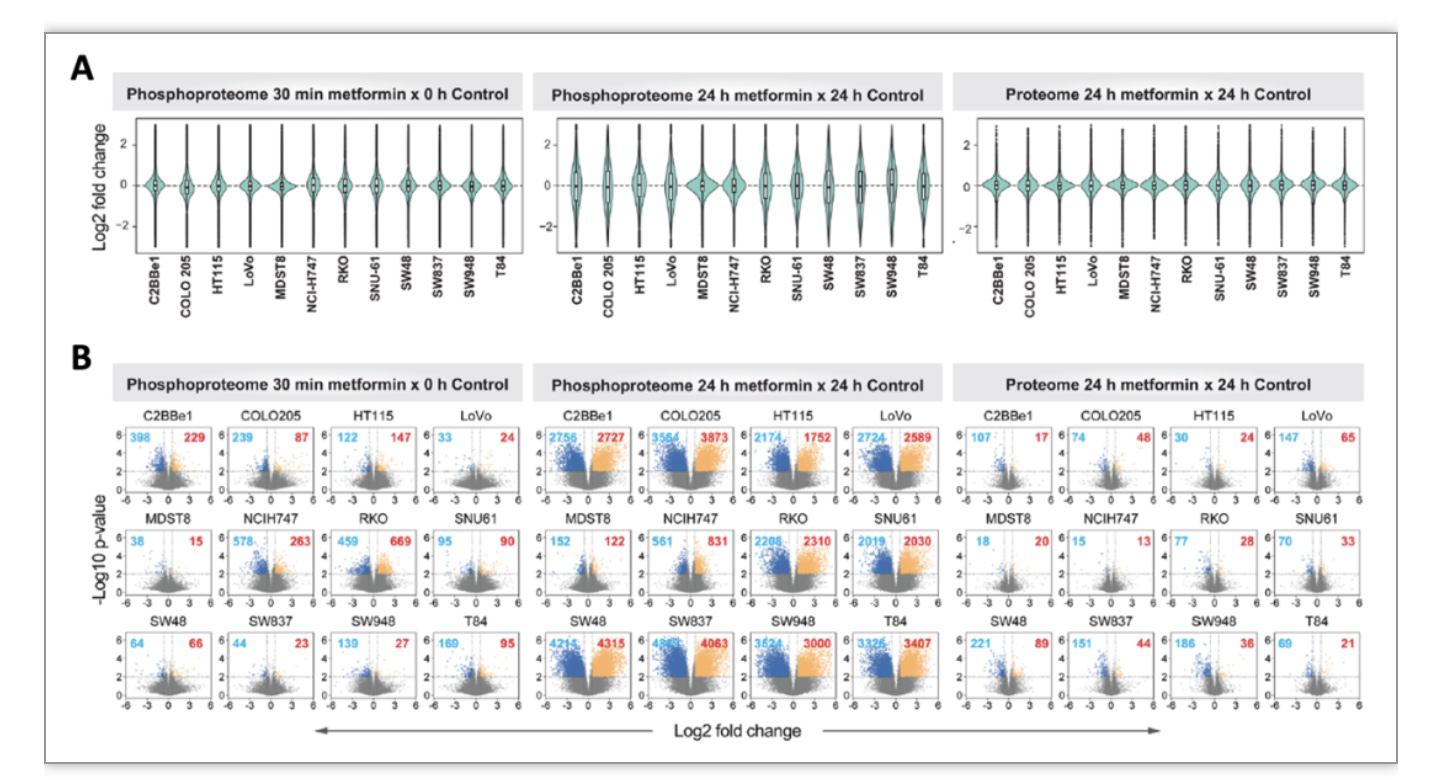
图2 二甲双胍作用30min和24h蛋白质组和磷酸化蛋白质组的变化对比
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)
考虑到上述异质性,作者建立MetScore评分系统为每个磷酸化位点打分以量化其在所有细胞系中的反应(-12到+12分),并根据变化程度把所有磷酸化位点分成5个级别,G1-G5。如G1部分是至少有四个细胞系出现该位点几乎全部上调,G5则是是至少有四个细胞系下调。通过比较G1和G5的motif序列(图3A-B),发现二甲双胍倾向于优先下调MAPKs、CDKs与mTOR。相反,AMPK与AKT的底物motif则被激活。作者也从OmniPath数据库[5]中提取的已知激酶靶点与信号通路进行了富集分析(图3C-F)。以MetScore评分系统对每个磷酸化位点赋分,成功鉴定到了与二甲双胍相关的一系列新位点(图4)。
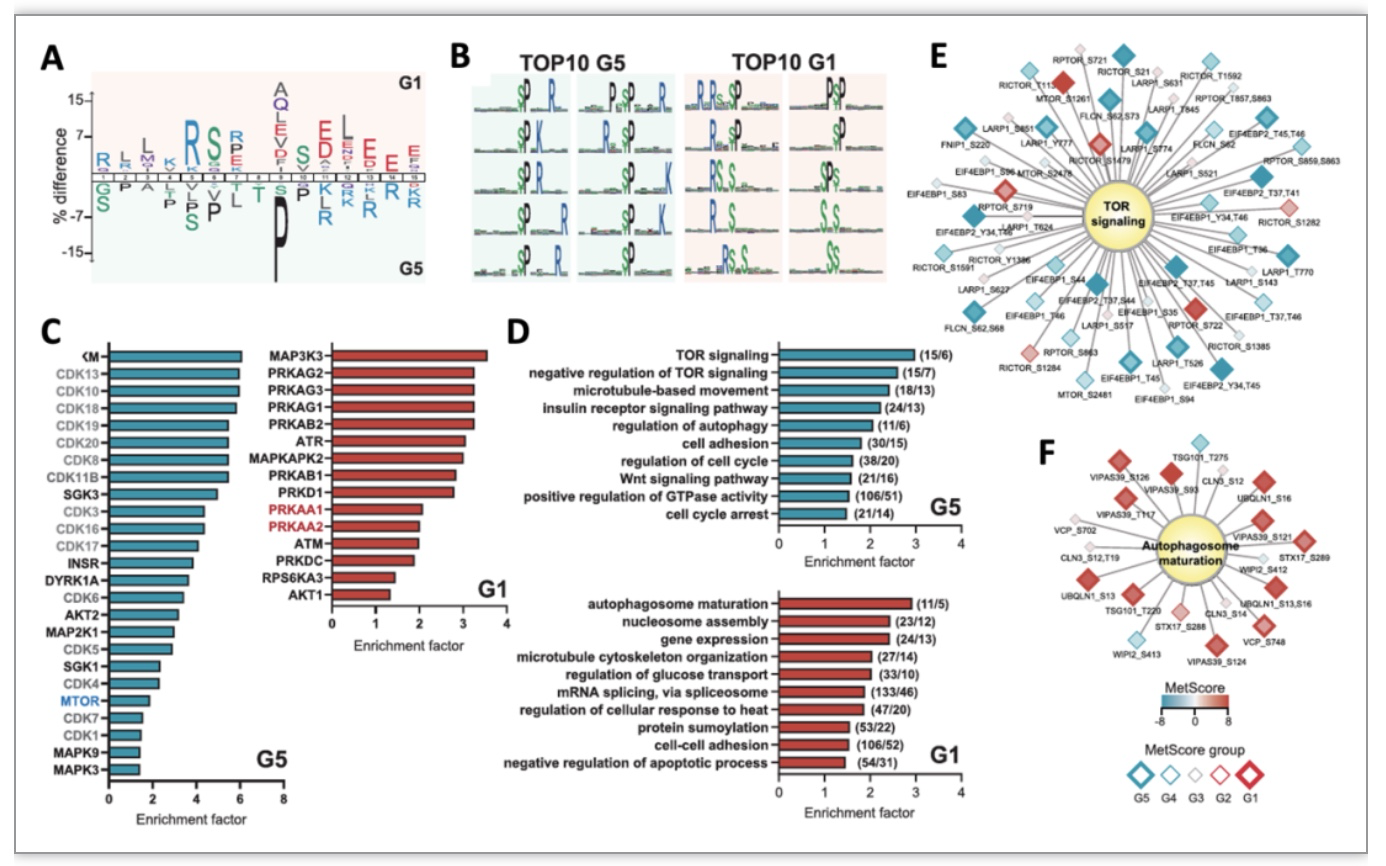
图3 使用MetScore打分鉴定二甲双胍相关磷酸化位点基序和功能富集分析
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)
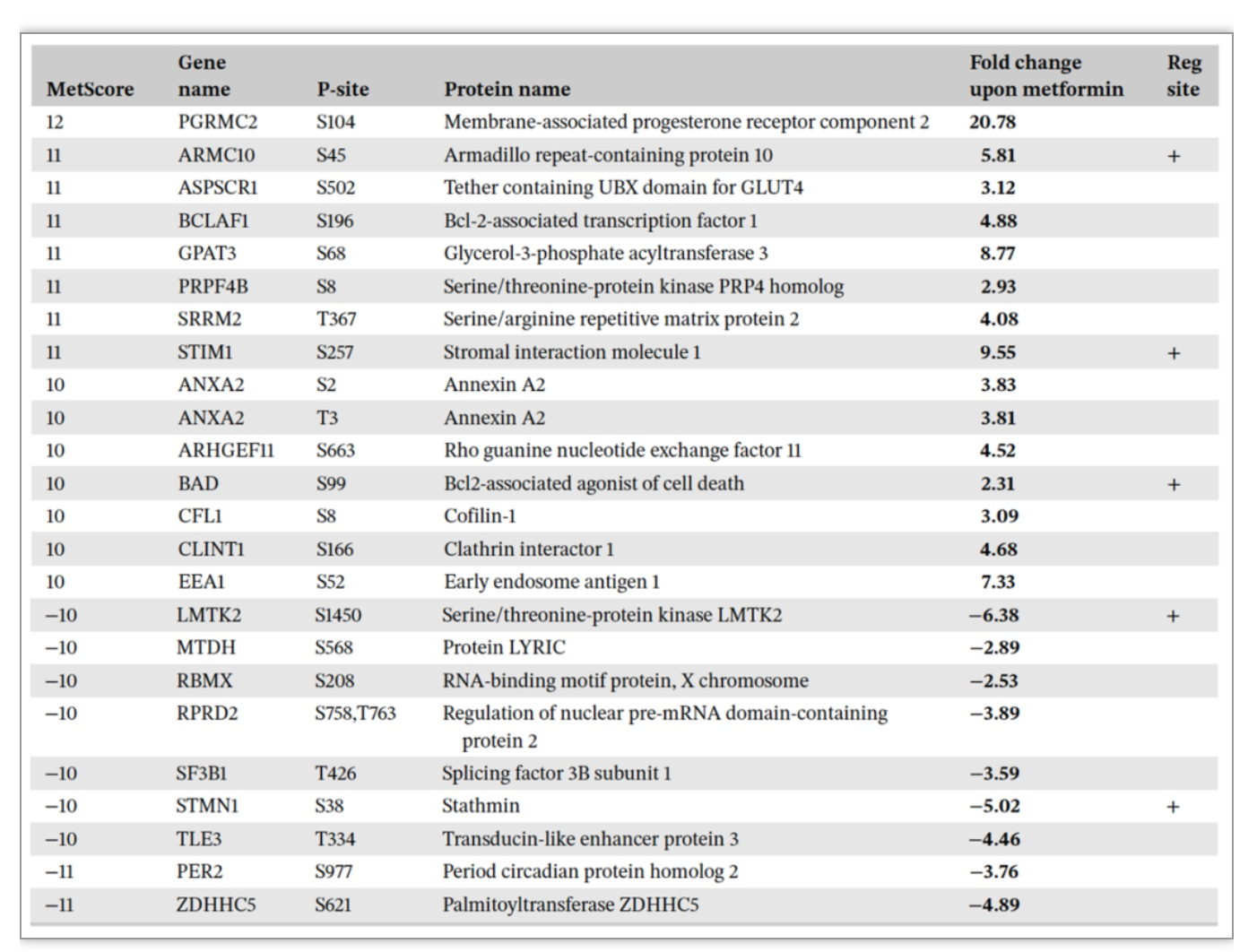
图4 “二甲双胍通路”的新磷酸化位点的发现
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)
多项研究已经表明,二甲双胍的已知作用机制主要依托于激活AMPK以及抑制mTOR通路,但其完整和具体的作用机制依旧尚未明确。为了进一步深入了解二甲双胍在单个细胞系中的药物作用机制,作者使用PHONEMeS软件[6]重建了连贯的信号调控路径,将激酶与底物磷酸化位点连接起来,从而形成一个大的信号网络以囊括与解释某种细胞中所有显著变化的磷酸化位点。作者抽取AMPK信号通路子网络展示分析其上游调控因子及下游效应因子(图5),发现AMPK子网络在不同细胞的环境中变化很大,如AMPK本身的活性在COLO205细胞出现了下调的情况。
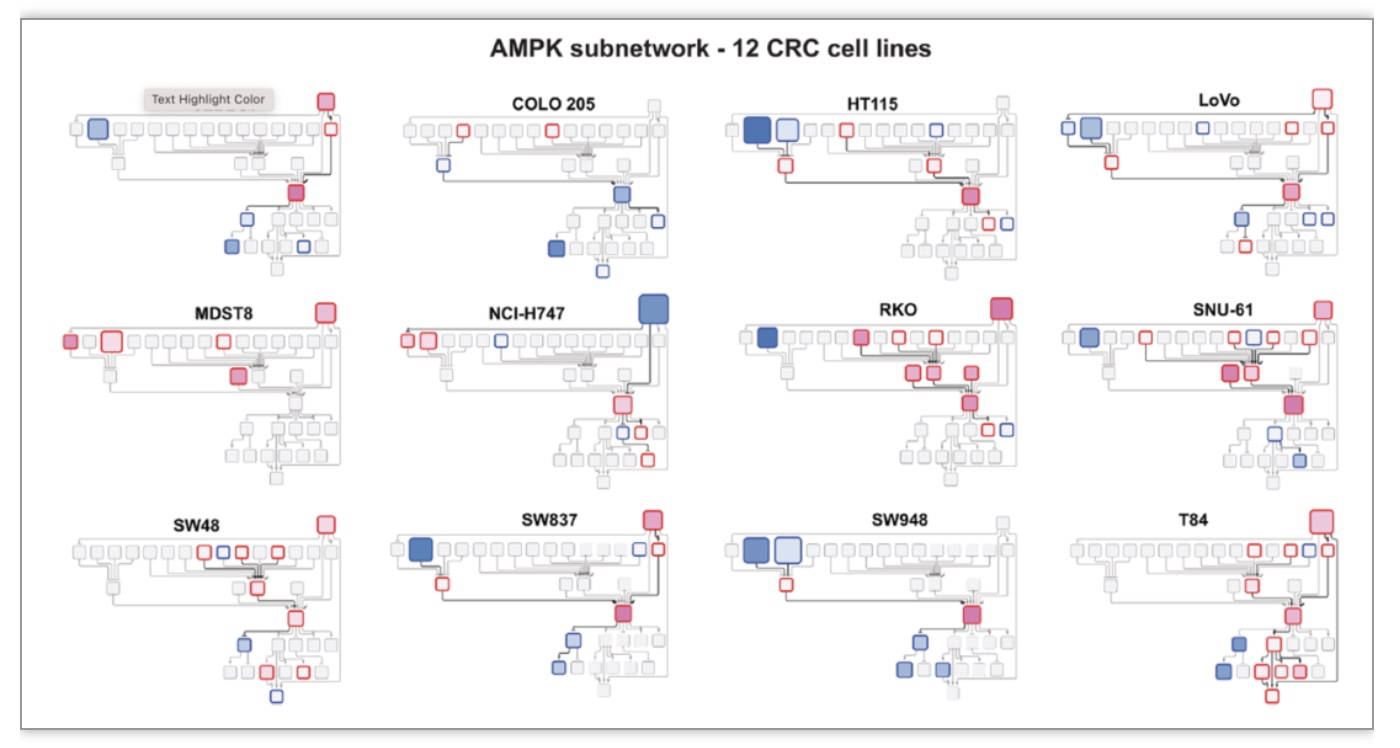
图5 PHONEMeS进行的网络分析揭示了CRC细胞中以AMPK为焦点的子网络的显著异质性
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)
最后,作者将磷酸化蛋白质组对二甲双胍响应的定量变化与药物-磷酸化蛋白质组学资源(如ATLANTiC数据库[7])比对(图6A),并结合了P100的重点磷酸化相关性的分析方法[8](图6B),筛选出可能与二甲双胍相互作用的药物分子,发现零星的前人实验已经证实了二甲双胍可以增强部分药物的抗癌效果。作者最后选取了六种药物化合物进行细胞生长抑制实验的验证(图6C-E),取得了较好的结果;其中,初步发现Navitoclax (一种Bcl-2蛋白家族抑制剂)的抑癌效果被二甲双胍显著增强。
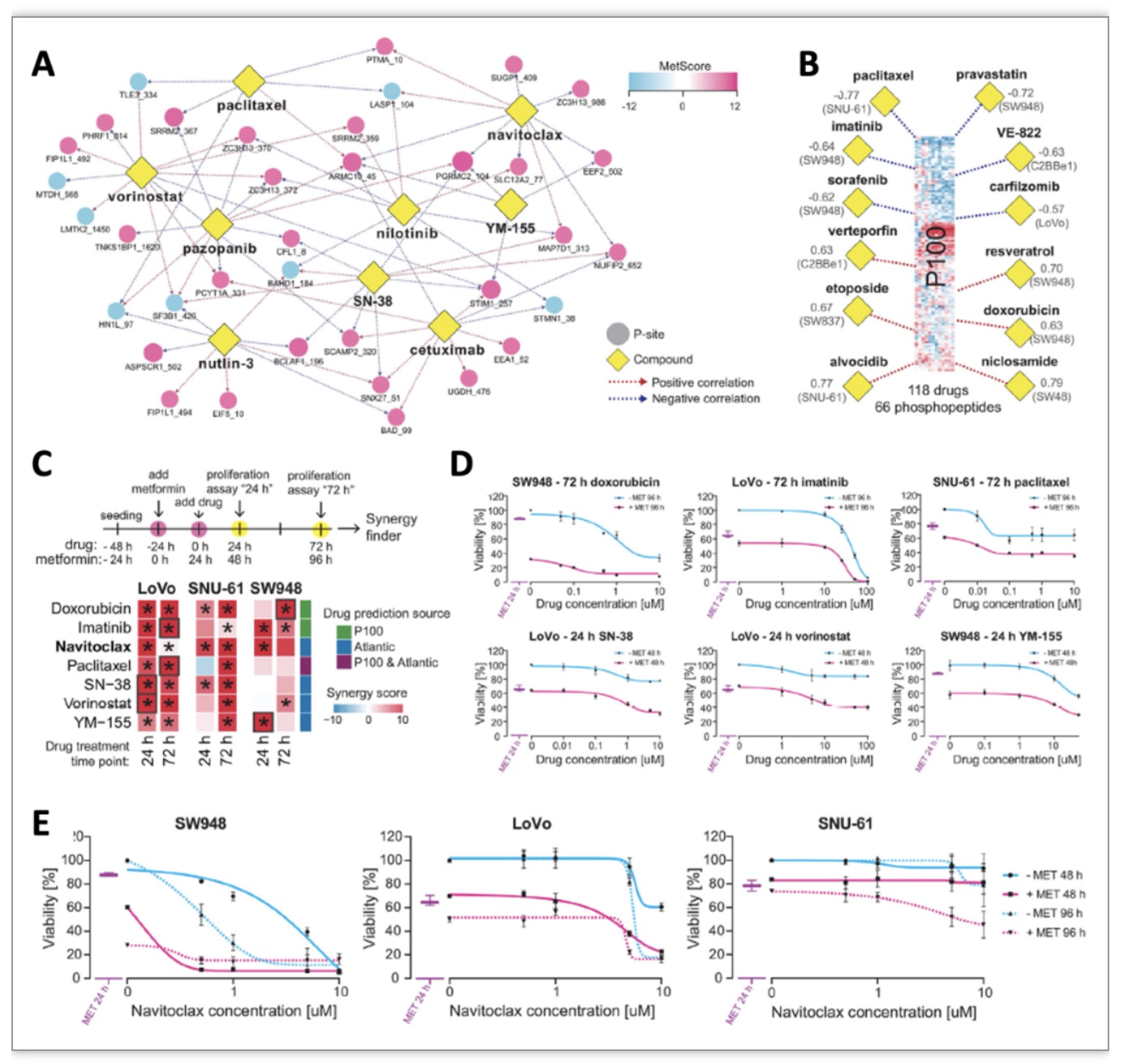
图6 二甲双胍与CRC抗肿瘤药物的协同作用
(图源:Salovska, Gao, Müller-Dott et al., Clin Transl Med, 2023)

