从低级生物病毒到高等生物人类,蛋白质的结构和功能都受到蛋白翻译后修饰(Post TranslationalModification,PTM)的密切调控[1-4]。蛋白翻译后修饰也是影响Covid-19大流行的关键因素之一[5-7]。探索spike蛋白的PTM图谱,并发掘其对三维结构及其与ACE2等宿主因子结合能力的影响,可为预防和治疗新冠提供更有效的科学见解。目前的蛋白质结构表征方法,如冷冻电镜,由于不同的物理化学条件,难以准确捕捉到动态的、多种PTMs对spike蛋白结构的影响;而深度学习方法完全依赖于一级氨基酸序列,忽略了PTM对蛋白质结构形成的影响。因此,为了预测蛋白翻译后修饰对spike蛋白结构和功能的影响,必须克服以上两个难点,建立PTMs对蛋白结构影响的预测方法。该研究基于蛋白质组学技术,绘制了全面的SARS-CoV-2 spike蛋白的高分辨率定量PTM图谱;同时基于诱变原理模拟PTM的物理化学特征,提出了一种预测spike蛋白翻译后修饰对蛋白结构影响的计算方法;并进一步评估了spike蛋白高度修饰的RBD区域及与受体蛋白ACE2的相互作用,以揭示其结合强度。本工作为研究翻译后修饰对spike蛋白三维结构的影响奠定了基础,为设计更有效的新冠治疗方法提供了科学见解。

为阐明PTM在SARS-CoV-2 spike蛋白的结构和毒力中的作用,研究首先基于LC-MS/MS技术绘制了spike蛋白PTM的高分辨率图谱。其次,基于诱变的方法,以一种氨基酸取代翻译后修饰的氨基酸,以模拟交替的物理化学特征,重建了由PTM引起的spike蛋白结构异质性。最后,研究评估了spike蛋白高度修饰的RBD区域及其与受体蛋白ACE2的相互作用,以揭示其结合强度。该研究为spike蛋白结构分析和设计更有效的新冠治疗方法提供了新的科学见解。研究工作流程如图1所示。
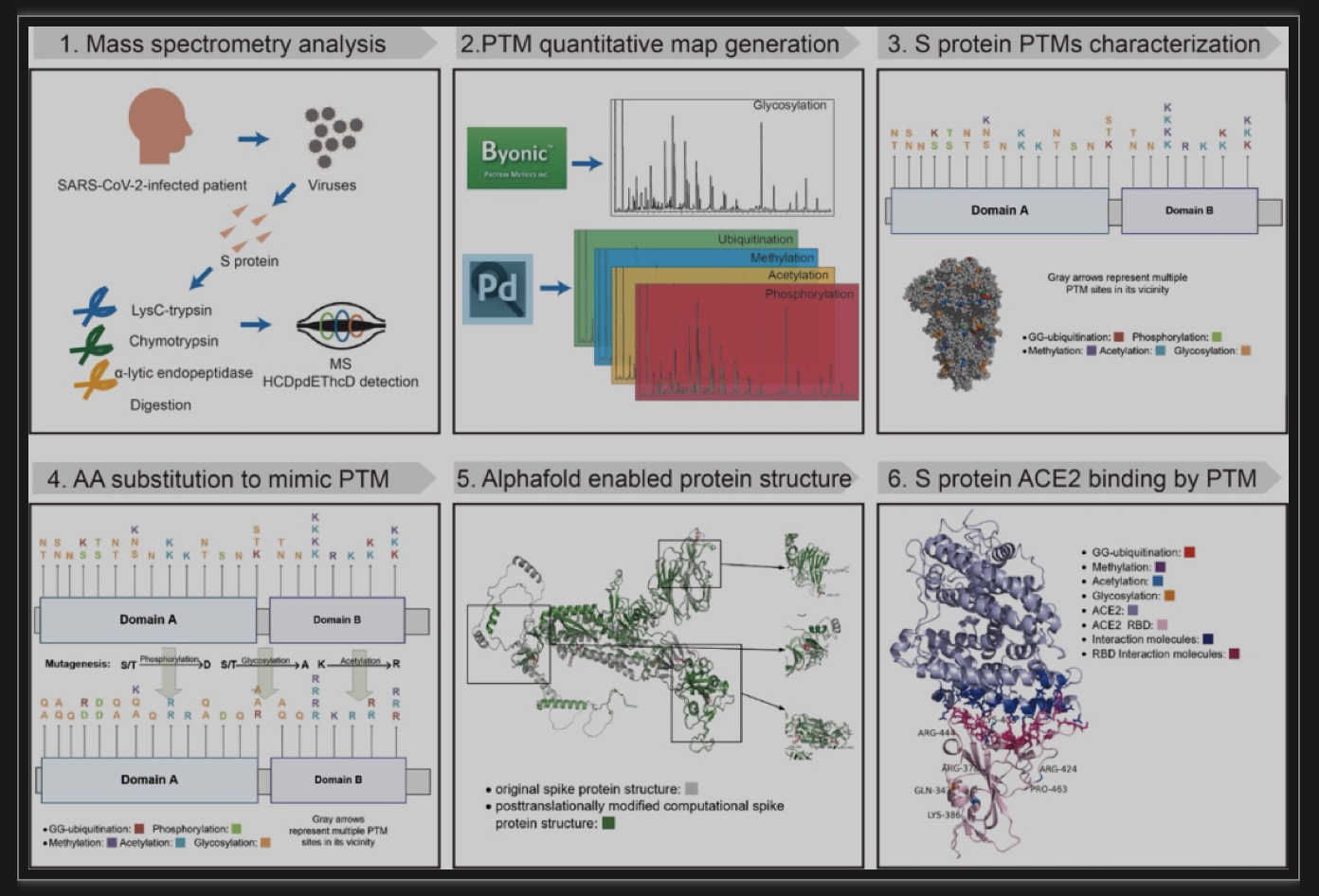
图1 SARS-CoV-2 spike蛋白PTM图谱构建和结构预测流程图
(图源:Liang BW et al.,Research, 2023)
该研究首次利用LC-MS/MS数据绘制了全面的SARS-CoV-2 spike的高分辨率定量PTM图谱,以阐明全面的PTM位点,发掘出包括磷酸化、乙酰化、甲基化、泛素化和糖基化等共计87个PTM位点。其中,在RBD区域确定了14个PTM位点(图2a, b)。同时,研究表明,PTM的发生频率对于理解其作用机制至关重要,尽管大多数PTM位点(67个)被单一类型的PTM修饰(糖基化),但其余的PTM位点(20个),如378K,被乙酰化修饰。以上结果表明,对PTM的全面表征可以呈现spike蛋白的翻译后修饰特征,进而有利于深入了解病毒的毒力和感染性的机制。

图2 SARS-CoV-2 Spike蛋白5个主要修饰位点的87个PTM位点分布
(图源:Liang BW et al.,Research, 2023)
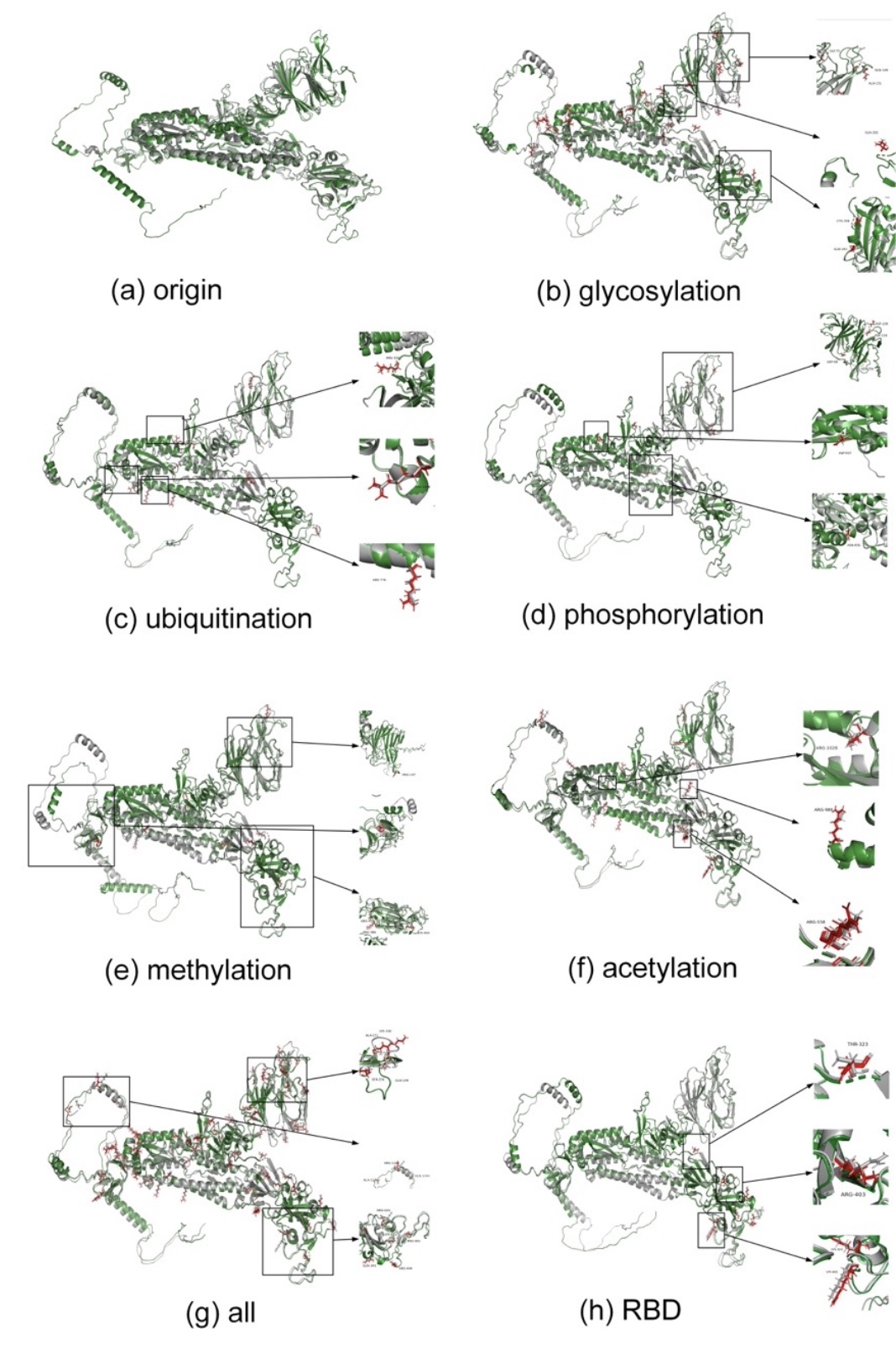
研究进一步基于诱变的方法,以一种氨基酸取代PTM修饰的氨基酸,从而模拟替代修饰所带来的物理化学的变化。并根据替换后的序列预测spike蛋白的结构,重建了由PTM引起的spike蛋白结构异质性。为评估和验证该方法的准确性,研究者将预测的结构与冷冻电镜的实验所得到的结构进行比对,以比较结果的相似性和差异。同时,为分析不同的PTM对spike蛋白结构的影响,研究者通过单一氨基酸诱变来评估具体PTM修饰类型的影响,并发现甲基化和乙酰化对spike蛋白结构影响最为深刻(图3)。
最后,为评估因PTM修饰导致的spike蛋白功能的变化,研究者系统地计算了spike蛋白和宿主因子(ACE2,ASGR1和KREMEN1)复合物残基的极性、极性和带电特性,进而分析其结合的相互作用。研究结果表明,PTM导致spike蛋白与宿主因子的相互作用位点发生深刻的变化,其中甲基化修饰的spike蛋白与ACE2宿主因子的结合力最高。该结果可对因PTM影响的蛋白质结构和功能提供启示,并有助于药物发现、抗体设计和SARS-CoV-2感染的有效治疗(图4)。
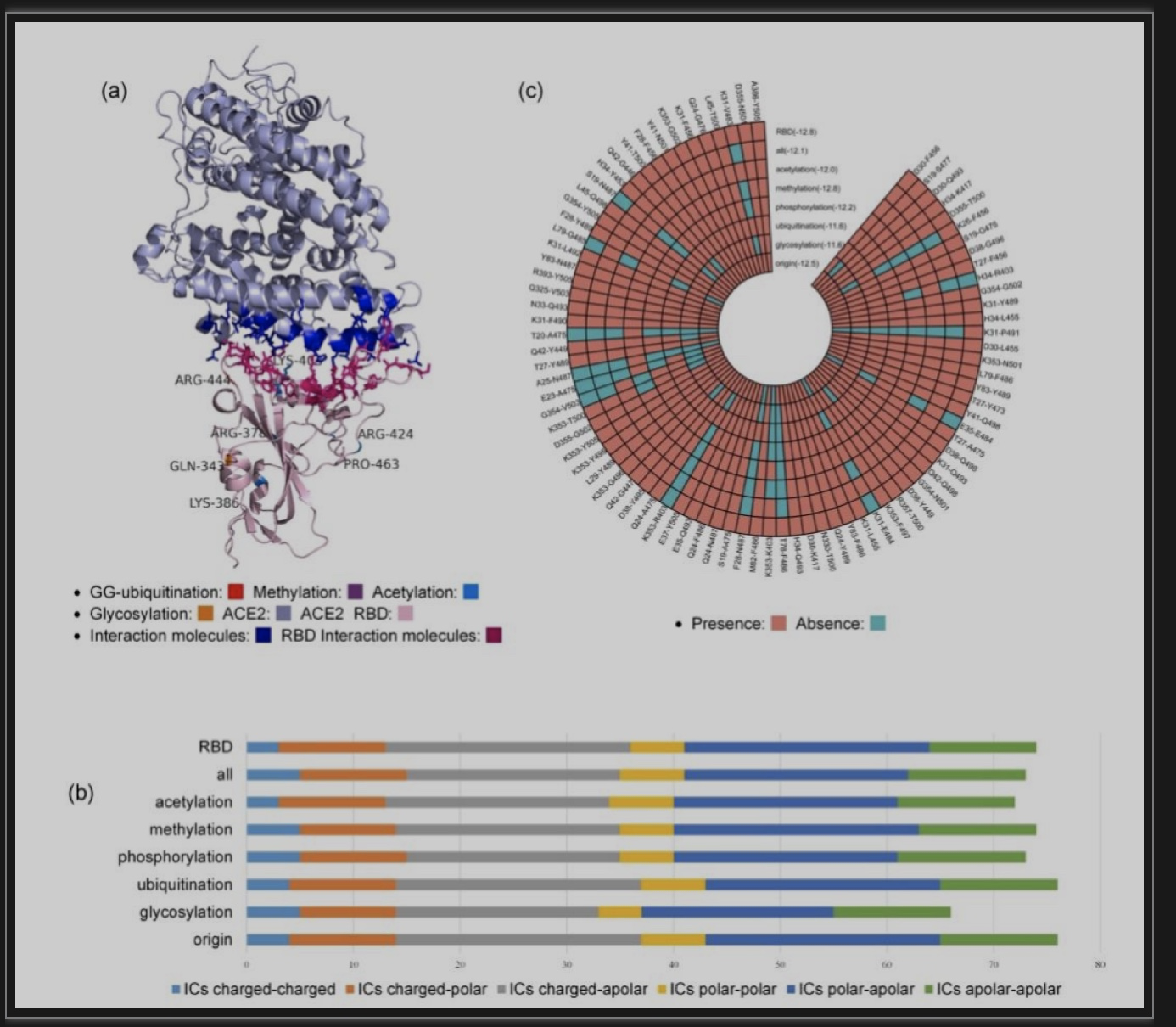
图4 翻译后修饰的spike蛋白与ACE2的结合力和相互作用位点。
(图源:Liang BW et al., Research, 2023)

