慢性胰腺炎(Chronic pancreatitis,CP)是一种慢性进行性消化系统疾病,主要病理表现为腺泡细胞损伤、持续性炎症和不可逆的胰腺纤维化。CP年发病率为4-14/100000人,患病率为120-143/100000人[1]。CP早期症状不典型,迄今尚无临床公认的病程阶段划分,疾病晚期极易与胰腺癌混淆。由于CP发病机制不明,当前临床治疗仍以手术或对症支持为主,但手术并不能恢复胰腺功能或终止胰腺纤维化进展。
巨噬细胞来源于分化成熟的单核细胞,其可以被经典或旁路配体激活并极化为不同表型进一步发挥靶向作用。损伤的胰腺腺泡细胞诱导以巨噬细胞为主的炎性细胞浸润,从而激活胰腺星状细胞(pancreatic stellate cells,PSCs),诱导胰腺纤维化。巨噬细胞还参与胰岛细胞和PSCs之间的胞间通讯。因此,巨噬细胞在CP病程中的作用广受关注,并被认为是免疫治疗向临床应用转化的关键切入点。
“Macrophages: A rising star in immunotherapy for chronic pancreatitis”的综述,回顾了巨噬细胞在CP病程的不同阶段与胰腺腺泡细胞、PSCs、其他免疫细胞和胰岛细胞的“交流”,这将有助于明确巨噬细胞在CP病程中的决定性作用。任何剂量和递送方式的进一步优化都将有利于提高CP治疗中巨噬细胞的靶向性。

一、巨噬细胞在CP早期的作用
CP诊断标志物开发才刚起步,不仅缺少早期诊断标志物,还缺少终末期确诊胰腺萎缩、纤维化、外分泌功能不全及可能出现的并发症的特异性生物标志物。用于鉴别诊断胰腺癌和CP相关疾病的生物标志物也缺乏明确区分。有研究者认为尿液中蓄积的物质可能优于血液,作为更早的慢性疾病诊断标志物。CP大鼠尿蛋白谱随疾病进展而波动:造模第2周典型病损尚未发生时,已鉴定出包括IL4RA在内的5种CP相关蛋白。有趣的是,IL4RA在急性胰腺炎中也存在表达差异,提示AP反复发作可能发展为CP。巨噬细胞选择性激活依赖IL-4RA信号,因此IL-4RA可能是潜在的CP早期诊断线索[2]。Legumain作为一种新发现的CP生物标志物,在患者CD68(+)巨噬细胞中持续高表达,检测Legumain可能有助于CP早期诊断。巨噬细胞相关免疫调节因子、促炎因子、MIC-1和TGF-β也可作为CP早期诊断生物标志物[3]。
二、巨噬细胞在CP进展期的作用
NF-κB是巨噬细胞向胰腺浸润的主要参与者。NF-κB促进MCP-1和TNF-α分泌,前者为巨噬细胞募集所必需,后者被视为胰腺损伤的主力。低剂量雨蛙素和NOD1配体联用可极大提高NF-κB活化效率,诱导巨噬细胞以MCP-1依赖方式向胰腺募集。胰腺腺泡-导管化生(ADM)是CP典型病理表现。巨噬细胞被表达KrasG12D的腺泡细胞吸引,通过细胞因子,如TNF和MMP9,促进ADM[4]。敲低腺泡细胞中EBPA可以上调CTGF,激活巨噬细胞,间接驱动ADM,该过程可能涉及PI3K和Hippo途径。巨噬细胞分泌的MMP作为NF-κB信号的靶点,驱动腺泡细胞转分化。巨噬细胞分泌的IL-18也被认为是驱动ADM的主要因素之一。胰腺浸润的巨噬细胞中NLRP3调节IL-18活性,通过EPX上调TGF-β、KRAS和MUC2,促进ADM。总之,巨噬细胞可能是胰腺腺泡细胞表型变化的原因之一,靶向巨噬细胞可能延缓ADM。此外,巨噬细胞对于胰岛β细胞和腺泡细胞再生至关重要。采用白喉毒素和Mac1 Sap清除胰腺F4/80阳性巨噬细胞,β细胞增殖减少,腺泡再生受损。体外共培养发现巨噬细胞具有诱导细胞特异性分化的潜能。细胞特异性损伤后,巨噬细胞极化为M2型或从M1型转变为M2型,极化的巨噬细胞表达不同的生长因子和Wnt配体,在胰腺修复和再生中发挥重要作用[5]。
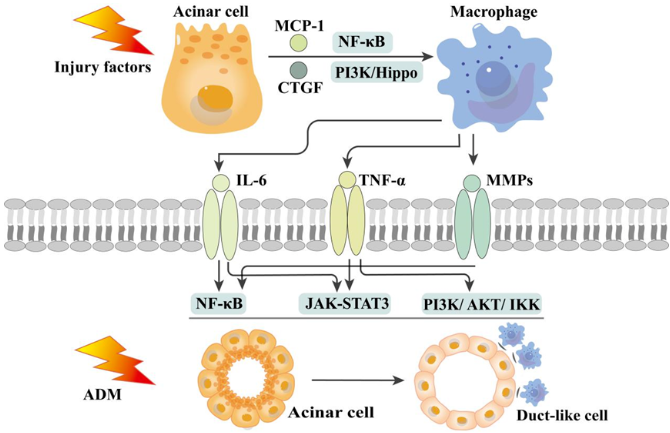
图1 巨噬细胞与腺泡细胞间的“交流”是ADM的驱动因素之一。
(图源:Hong Xiang, et al., Pharmacol Res, 2022)
三、巨噬细胞在CP晚期的作用
CP患者胰腺纤维化伴有巨噬细胞为主的炎性细胞浸润。敲降胰腺腺泡细胞NF-κB p65加重雨蛙素诱导的CP小鼠胰腺纤维化,而敲降巨噬细胞NF-κB p65可以减少细胞因子生成,改善CP纤维化。巨噬细胞分泌的MMP10在CP进展中可能作为RelA/p65依赖性抗纤维化因子发挥作用[6]。Th2细胞释放IL-13,将ADM病变中的炎性巨噬细胞转变成为Ym1+交替激活巨噬细胞,进一步释放IL-1RA和CCL2,驱动胰腺纤维化。二丁基锡中二氯诱导的胰腺炎纤维化大鼠模型中,CD68阳性M1巨噬细胞首先增加,其次是表达CD68和CD163的M2巨噬细胞[7]。巨噬细胞与PSCs相互作用生成ECM促进纤维化形成,这似乎与M2巨噬细胞的抗炎特性相悖,目前尚不清楚M2型巨噬细胞在胰腺病理再生过程中是否始终发挥促纤维化作用,以及转化过渡的节点。持续的炎症反应和胰腺纤维化破坏胰腺内分泌功能,诱发糖尿病,临床上称为3C型糖尿病。生理条件下,巨噬细胞分泌低浓度IL-1β刺激β细胞增殖,维持胰岛发育和体内血糖稳态。CP病变导致大量巨噬细胞被募集到胰岛,胰岛巨噬细胞通过激活炎症小体并释放IL-1β,诱导胰岛素抵抗和β细胞凋亡,不可逆地破坏胰岛细胞功能。活化的巨噬细胞释放TNF-α,是诱导胰岛β细胞损伤及胰岛素抵抗的关键介质[8]。肥胖个体的脂肪组织和其他细胞中TNF-α表达显著高于健康个体。TNF-α通过促进脂肪分解代谢,增加血浆脂肪酸水平,并通过抑制胰岛素受体,降低胰岛素活性,这可能是3C型糖尿病患者发生胰岛素抵抗的原因之一。
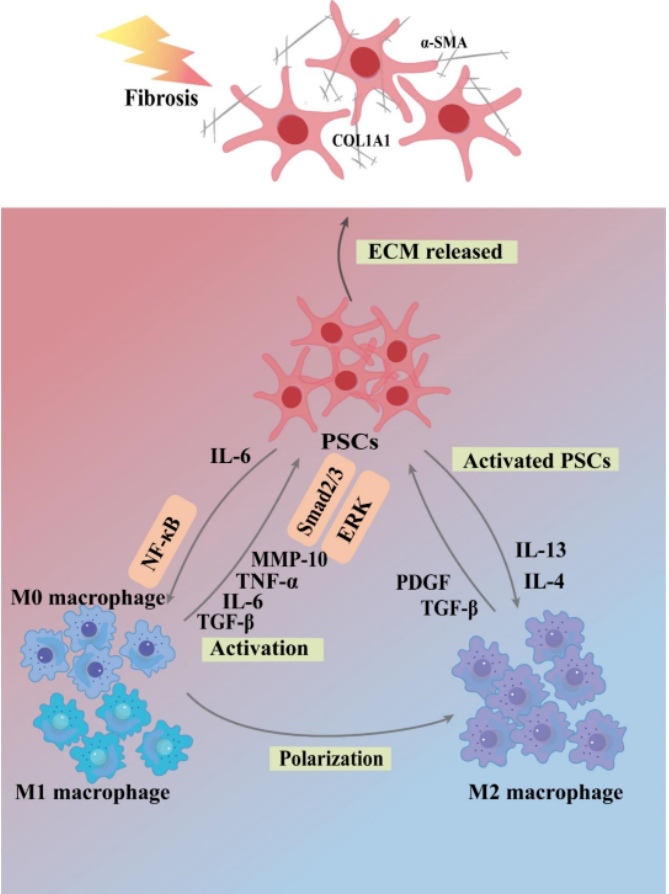
图2 CP纤维化过程中巨噬细胞和PSCs之间的联系。
(图源:Hong Xiang, et al., Pharmacol Res, 2022)
四、CP治疗中的巨噬细胞靶向免疫治疗
小檗碱是一种天然的异喹啉生物碱,提取自小檗科各种植物(包括小檗、水生小檗、普通小檗、加拿大海棠和中国红豆杉)的根和根茎。小檗碱以AMPK依赖的方式抑制TGF-β/Smad信号传导和M2巨噬细胞极化,阻断PSCs激活和ECM沉积,从而改善CP症状和胰腺纤维化[9]。达沙替尼是一种第二代口服广谱TKs抑制剂,在欧洲和美国,已成为治疗慢性白血病的一线和二线药物。达沙替尼通过GSK-3β/TKs/β-catenin通路抑制PSCs增殖和活化,逆转活化的PSCs对M2型巨噬细胞极化的促进作用,从而抑制胰腺纤维化[10]。
尽管COX抑制剂可能的副作用限制了它们的应用,但这仍然是一种可行的巨噬细胞靶向CP治疗策略。舒林酸降低胰腺中TNF-α和MCP-1表达,从而减少Mac-3阳性巨噬细胞浸润[11]。罗非昔布抑制COX-1和COX-2转录,减少巨噬细胞浸润[12]。布洛芬通过减少活化的巨噬细胞浸润,抑制M1极化和促炎因子生成,降低腺泡细胞去分化和导管化[13]。黄芩苷是从双子叶唇形科植物黄芩的干根中提取的一种黄酮,可以通过降低PSCs上清液中的MCP-1水平来抑制巨噬细胞迁移,机制涉及TAK1、TGF-β1、TGFβR1、NF-κB等[14]。异甘草素是一种从甘草根中分离出来的膳食黄酮,通过抑制PSCs激活和胰腺巨噬细胞浸润,并通过NF-κB通路抑制巨噬细胞M1极化,改善胰腺纤维化和炎症[15]。HDACs是一类可以调节组蛋白和非组蛋白乙酰化的蛋白酶,目前,HDAC抑制剂在治疗炎症和慢性纤维化疾病方面受到越来越多的关注。选择性HDAC抑制剂MS-275能有效减少CP急性期和慢性期巨噬细胞向胰腺募集,并直接抑制巨噬细胞活化[16]。由于HDAC抑制剂丙戊酸可引起ADM,因此应谨慎使用。
G-CSF临床上主要用于预防和治疗肿瘤放疗或化疗引起的白细胞减少症以及治疗骨髓造血功能障碍,通过增加巨噬细胞数量抑制纤维化。骨髓移植CP小鼠经G-CSF治疗后骨髓源巨噬细胞数量增多,浸润增强,巨噬细胞抗纤维化作用可能是G-CSF动员的新分化细胞与胰腺固有细胞相互作用的结果[17]。
靶向药物递送系统克服了传统药物递送系统缺乏特异性、耐受性差和毒性效应的缺点,具有靶向性、浓度、控制释放和无毒生物降解性等优势,特别适合用于巨噬细胞靶向治疗。例如,C型凝集素受体可以与病原体的糖原结合,并招募表达甘露糖受体C 1型(MR,CD206)的巨噬细胞,以增强抗原呈递和药剂传递,从而实现更好的靶向性和局部药物释放[18]。具有封装结构的脂质体可以通过配体靶向巨噬细胞,据报道,携带克洛膦酸的脂质体可以诱导巨噬细胞凋亡,通过耗尽巨噬细胞来改善病理损伤[19]。脂质体通过吞噬作用被巨噬细胞吸收,有趣的是,M1和M2极化的巨噬细胞似乎可以识别针对不同配体的脂质体;例如,M2极化的巨噬细胞偏爱吸收CD163配体的脂质体。肽序列M2pe对小鼠M2巨噬细胞(包括肿瘤相关巨噬细胞,TAMs)具有极高亲和力,促细胞凋亡靶向肽经M2pep传递到小鼠TAMs,可以减少TAMs的数量,提高生存率[20]。虽然用肽制剂靶向巨噬细胞显示出良好的治疗前景,但距其临床应用还有很长的路要走。
五、总结与展望
胰腺ADM、纤维化、免疫调节和胰岛功能障碍是CP典型的病理特征。不同数量和极化表型的巨噬细胞与胰腺实质细胞和其他免疫细胞相互串扰,通过激活相应信号通路,最终决定CP严重程度。目前,大多数CP治疗药物主要作用于调节巨噬细胞极化、浸润和募集。随着对CP病程中不同巨噬细胞及其相关介质调节机制的研究不断深入,巨噬细胞靶向治疗被认为是CP正确治疗策略的关键环节。

