G 蛋白偶联受体(GPCR)是人体中最大的膜蛋白家族,包括800多个成员。GPCR结构包括七个跨膜α螺旋(TM1-TM7)结构域以及多个胞外和胞内环形结构。GPCR在许多重要的生理过程中发挥着关键作用,包括视觉、味觉、嗅觉、神经递质信号转导、内分泌调节和免疫反应等。目前,市场上FDA批准的药物中三分之一作用在GPCR上;然而,只有大约100种GPCR被用用临床药物开发的靶点。
通过X射线晶体衍射和冷冻电子显微镜等技术,近年来多个GPCR的高分辨率结构被解析,这极大地推动了我们对GPCR所参与信号转导的科学认识。这些结构为深入理解GPCR的功能和药物设计提供了重要的基础[1-2]。然而,它们所呈现的均为静态结构,构象之间的转换以至动态变化信息非常有限。目前已解析的GPCR结构多局限于低能的全息非活性或者终端激活两个终点构象[3],对于中间态构象结构和功能研究甚少。GPCR的构象转换和动力学研究正在成为继静态结构生物学后的研究热点,理解中间态构象在信号转导中的作用对于揭示GPCR的激活过程和调控相关信号至关重要。报道了在19F定量核磁共振指导下分离和聚集中间态构象的可行性。该研究同时报道了一个保守的位于GPCR的TM7/H8的R2917.56/ R2938.48和TM6上的H2306.32之间的“cation-π”微调切换开关,作为“门卫”来调节G蛋白插入胞内G蛋白结合腔。不同于先前确定的TM3和TM6之间的离子锁主要调节GPCR两个非活性状态之间的构象转换[4],该“cation-π”开关主要调节活性构象和非活性构象之间的转换。

首先,研究人员以腺苷A2A受体(A2AR)作为模型进行全分子动力学模拟(MD),生成了A2AR-Gαsβγ与部分激动剂(LUF5834)或全激动剂 (NECA)结合的复合物结构(图1)。NECA-A2AR-Gαsβγ模型显示A2AR的胞内环3(ICL3)和Gαs的α-helix domain(AHD)之间有两个分子间盐桥。研究人员发现这些盐桥不存在于预测的LUF5834-A2AR-Gαsβγ复合物中。 这种蛋白相互作用的特异性启发研究人员设计出能够猝灭全效激动信号以及相对应的全激动构象,并能稳定于中间态构象的A2AR突变体。
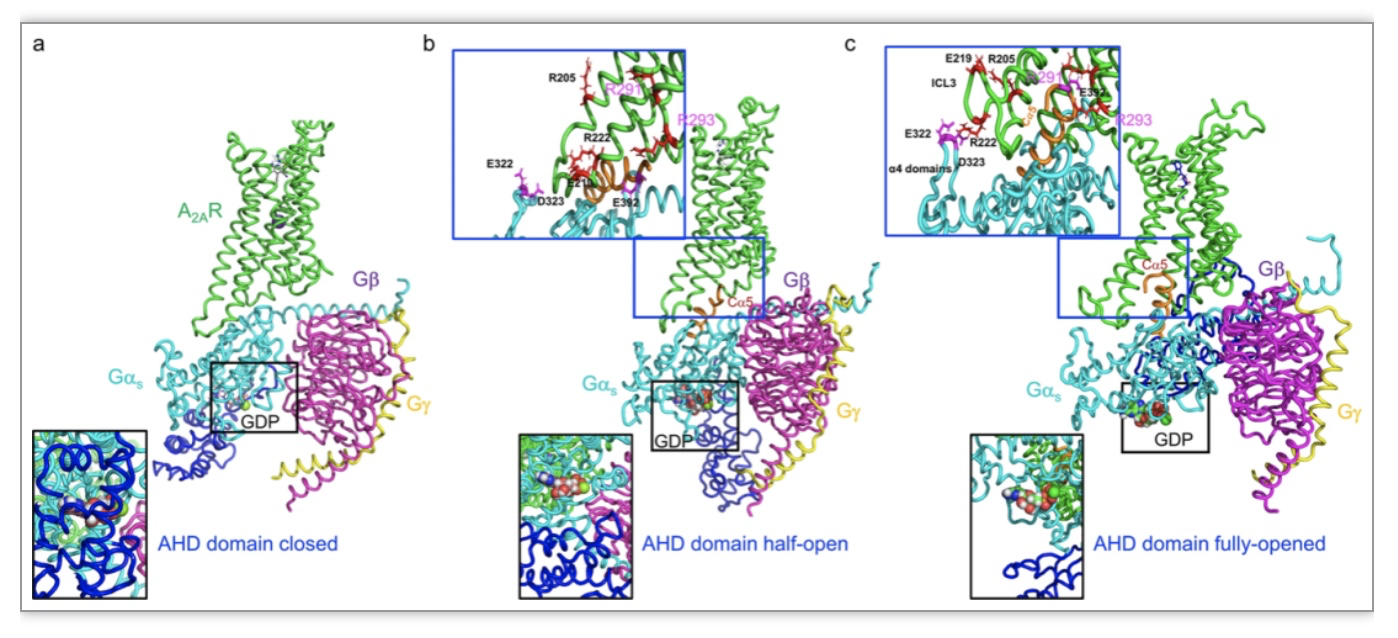
图1. 基于模拟的部分激动剂和全激动剂的A2AR-Gαsβγ复合物结构
(图源:X, Wang et al., Nature Communications, 2023)
为了观测这些A2AR突变体构象的变化,研究人员利用氟(19 F)对微环境变化敏感的特性建立了一个19F的核磁共振系统来探测A2AR结构的变化[5]。研究人员在A2AR的V229C处固定19F探针来探测A2AR受体从非活性态构象 (S1) 到完全激活态构象 (S5) 之间的变化(图2)。
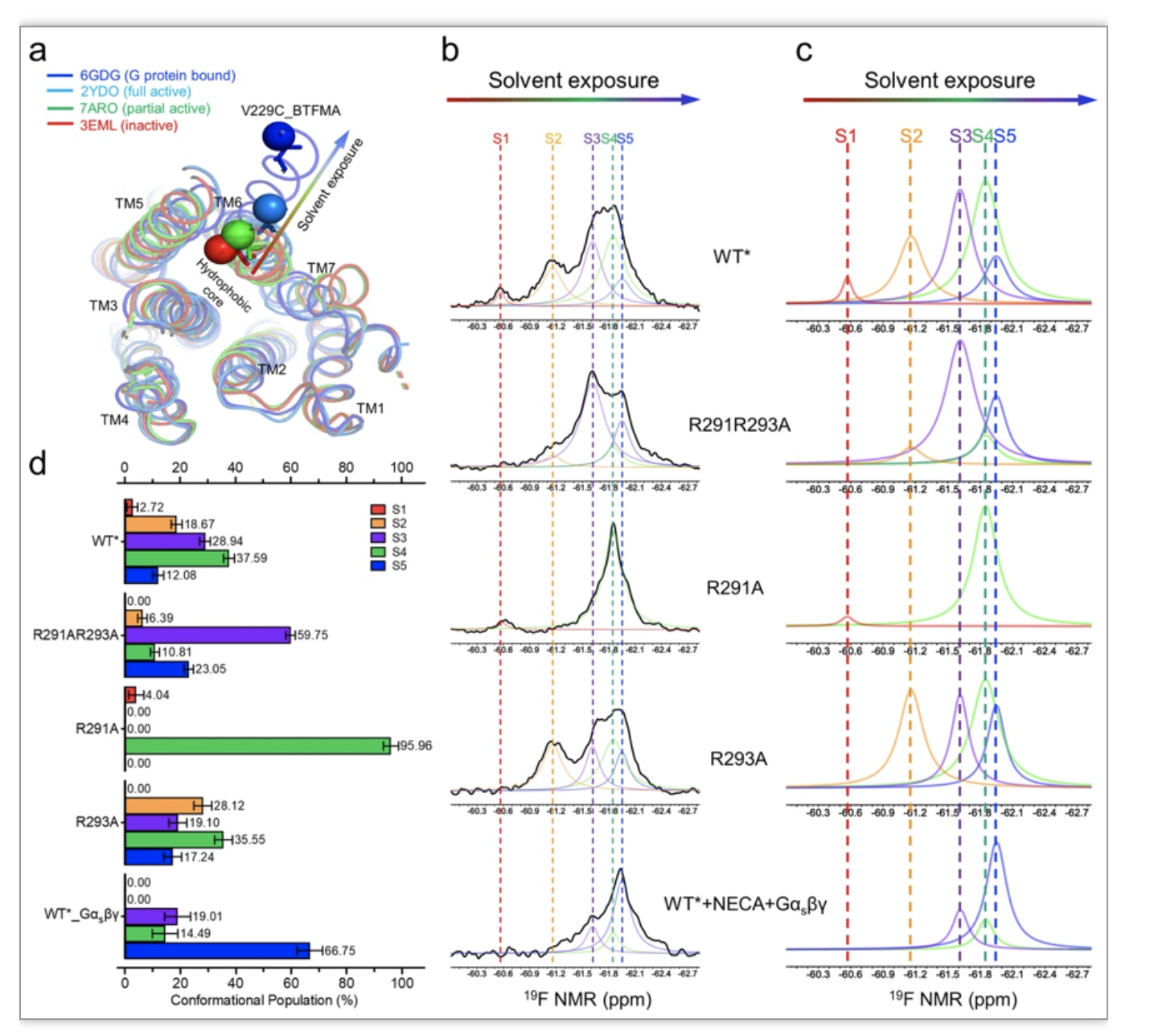
图2. 通过在V229C上进行19F标记探测不同构象偏向突变体的NMR
(图源:X, Wang et al., Nature Communications, 2023)
在受体激活过程中,TM6会从疏水区旋转到亲水区逐步暴露V229C残基至水环境中,因此这些19F-NMR谱图根据不同的溶剂暴露程度勾勒出构象状态,其中五个构象状态S1到S5的进展顺序从低磁场(水暴露度较小)到高磁场(水暴露度更大)。基于核磁共振数据,研究人员揭示了A2AR的R2917.56和R2938.48在受体激活过程中的作用通过调节G蛋白结合腔的来调节受体异构变化。
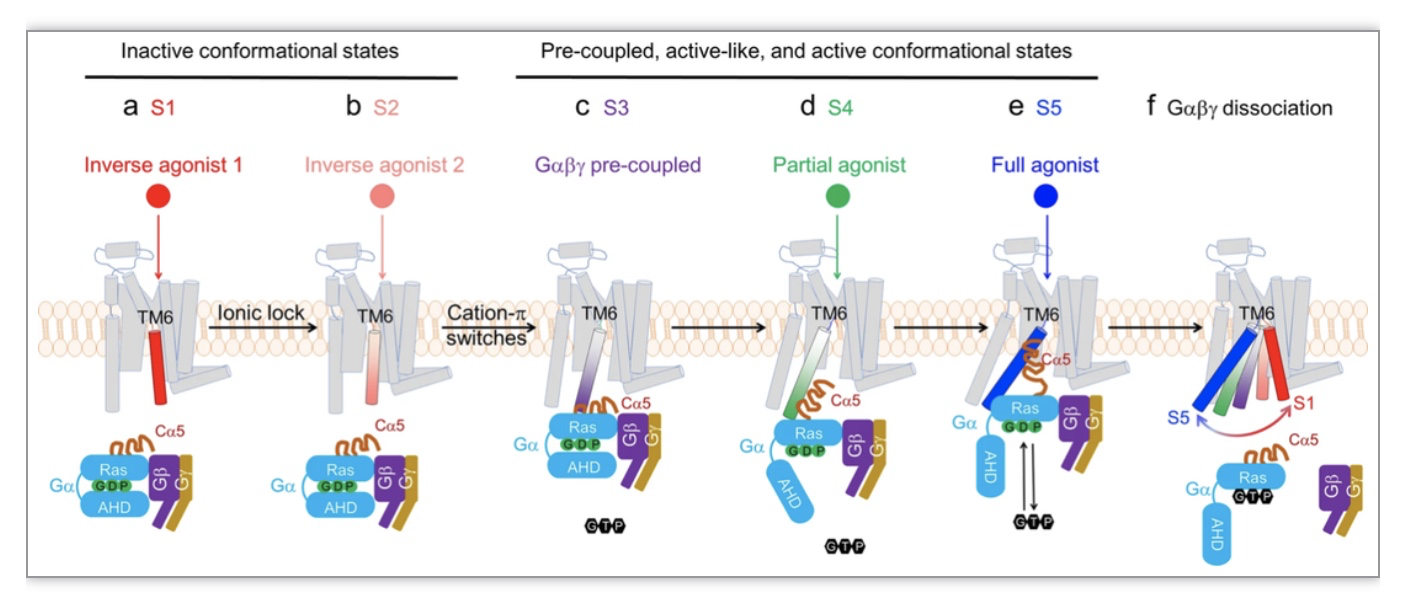
图3. TM3 和 TM6 之间的离子锁以及 TM7/H8 和 TM6 之间的cation-π 微开关在 A2AR 激活中的变构作用
(图源:X, Wang et al., Nature Communications, 2023)

