丙型肝炎病毒(hepatitis C virus,HCV)是引起人类慢性肝脏感染的重要病原体之一,HCV慢性感染会导致一系列肝脏病变,如肝脏脂肪变性、炎症、纤维化、肝硬化和原发性肝癌。据WHO报导[1],全球约5800万人患慢性丙型肝炎;每年新增约150万丙肝病毒感染者,约有29万人死于HCV导致的疾病。随着索非布韦(sofosbuvir)等特效药物的发现,目前确诊的HCV感染者治愈率较高,如2016~2018年冰岛的TraP HepC(treatment as prevention for hepatitis C)项目795例确诊感染者中,717例感染被治愈,治愈率高达90.2%[2]。由于HCV感染有较强的隐蔽性,目前丙型肝炎的诊断率仅约20%[3],因此深入了解HCV感染宿主细胞的生物学过程及其导致慢性感染的致病机制,对于进一步优化丙型肝炎的诊治依然具有重要意义。RNA化学修饰是近年来相关领域的研究热点,包括在腺嘌呤、鸟嘌呤、胞嘧啶等碱基发生的甲基化、乙酰化等修饰,其中甲基化是最主要的修饰形式。m6A(N6-腺苷酸甲基化,N6-methyladenosine)作为丰度最高的RNA修饰形式,在HCV病毒感染中起重要作用,通过修饰病毒RNA以及细胞转录产物影响病毒感染。
作者首先对HCV生物学特性和RNA甲基化修饰进行了具体描述,进而从病毒和宿主细胞两方面阐述了HCV 基因组的m6A修饰和HCV感染后细胞RNA甲基化修饰的研究进展,最后总结了目前该领域还需深入研究的科学问题。

HCV感染宿主过程中,HCV与宿主体内的低密度脂蛋白/极低密度脂蛋白结合形成病毒脂质颗粒并被转运,随后被肝细胞膜表面低密度脂蛋白受体(LDL-R)识别进入肝细胞[5]。B族-Ⅰ型清道夫受体(SR-BⅠ)、CD81、紧密连接蛋白claudin-1、occludin等至少4种宿主蛋白参与病毒进入宿主细胞的过程。病毒RNA脱壳进入细胞质,并在粗面内质网(rER)处被翻译。胞质中的核糖体被病毒RNA 5’-NTR IRES直接招募至翻译起始处并完成多聚蛋白的合成[6]。rER处含有细胞蛋白酶,可切割多聚蛋白N端的部分区域,多聚蛋白其他部分的裂解则由病毒蛋白酶NS2-NS3以及NS3-NS4A复合物完成。病毒蛋白NS5B具有RNA依赖的RNA聚合酶活性,与NS5A等多种病毒蛋白以及VAP-A、VAP-B、CPYA等宿主蛋白相互作用,共同组成HCV复制酶复合体[7],以HCV +ssRNA基因组为模板,复制产生-ssRNA,作为子代病毒+ssRNA基因组合成的模板。新产生的+ssRNA既作为翻译和复制的模板,也参与HCV病毒颗粒的组装。
HCV病毒颗粒装配起始于脂滴表面,核壳蛋白招募非结构蛋白、病毒RNA以及复制复合体等结构至脂滴相关膜结构附近,组装成具有感染性的病毒颗粒。核衣壳被认为在内质网膜附近形成,E1、E2、p7、NS2以及多种宿主细胞因子在内质网处聚集;病毒包膜通过内质网膜出芽而获得。装配完成的病毒颗粒通过细胞分泌被释放到胞外。
细胞内RNA甲基化修饰系统,根据其功能的不同,可分为甲基转移酶(writer)、去甲基化酶(eraser)、甲基结合蛋白(reader)三类。RNA甲基化修饰以S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)为甲基供体,由相应的甲基转移酶介导。真核生物RNA的m6A修饰由一种高度保守的甲基转移酶复合体在细胞核内完成,该复合物由多种蛋白组成,其中甲基转移样酶3(Methyltransferase Like 3, METTL3)和甲基转移样酶14(Methyltransferase Like 14, METTL14)含有SAM结合位点和具有催化功能的DPPW(Asp-Pro-Pro-Trp)模体,METTL3和METTL14组成甲基转移催化核心,包括WTAP、RBM15、VIRMA、ZC3H13、HAKAI在内的多种其他蛋白质参与形成催化复合体[8]。RNA m6A修饰主要发生在序列为DRAmCH(D:A/G/U;R:G/A;H:A/C/U)的模体上,m6A常出现于RNA 3’-NTR以及终止密码子附近,但相关研究也显示细胞RNA内大量DRACH模体并不发生甲基化修饰,提示m6A修饰可能还存在其他的选择性或特异性机制。此外,包括HCV在内的单正链RNA病毒,其基因组并不进入细胞核内,但病毒RNA在细胞质复制过程中,同样受细胞RNA修饰系统的调控[9]。研究人员在肝肿瘤细胞系Huh7细胞的细胞核与细胞质中均检测到METTL3和METTL14[9-10],提示RNA甲基化酶可在细胞质中发挥作用。
目前发现的m6A去甲基化酶主要有两种,即FTO和ALKBH5,均属于Fe2+和α-酮戊二酸依赖的加双氧AlkB家族蛋白,可对RNA上的N-甲基化修饰碱基进行氧化去甲基化[11-12]。FTO与人类肥胖和能量代谢有关[11],在急性髓细胞型白血病和恶性胶质肿瘤中起促癌作用[13]。ALKBH5在机体免疫应答反应中发挥重要作用,多种病毒感染细胞时,细胞核蛋白DDX46招募ALKBH5使DDX46结合的RNA发生去甲基化,使RNA阻滞在细胞核中,无法进行蛋白质翻译,降低干扰素产生,抑制免疫应答反应[14];此外,ALKBH5可在病毒感染细胞内调节代谢基因表达,调节病毒感染诱导的细胞代谢重编程[15]。HCV基因组的去甲基化由FTO完成[9],目前未发现ALKBH5参与HCV基因组去甲基化。
m6A甲基化可通过多种形式调控RNA代谢,如通过改变其碱基配对形式影响其二级结构,但最主要的机制是招募RNA甲基结合蛋白(即reader蛋白)完成下游步骤。目前发现的reader蛋白主要可分为两类,第一类直接与m6A碱基相结合,包括YTH家族、真核生物转录起始因子eIF3、IGF2BP等;第二类则识别m6A介导的二级结构,如HNRNPA2B1。不同m6A结合蛋白在细胞中的定位和分子功能各不相同,如定位于细胞质的YTHDF1和YTHDF3促进mRNA翻译[16-17];YTHDF2与包含m6A修饰的mRNA结合后,影响mRNA稳定性,促进mRNA降解[18];细胞核内的m6A结合蛋白YTHDC1调控mRNA前体的选择性剪接[19]。多种m6A结合蛋白的具体功能和作用机制还有待进一步阐明。
m6A修饰在病毒感染过程中的作用也逐渐引起重视。RNA甲基化修饰主要通过两种途径影响病毒感染:(1)修饰病毒的转录产物,发挥抗病毒或促进病毒感染的作用;(2)通过甲基化修饰细胞转录产物调节病毒在宿主细胞内寄生的微环境。
目前研究HCV基因组m6A甲基化的功能性研究采取的主要研究路线是构建HCV基因组m6A修饰峰值区位点突变体(该位点突变后不发生甲基化修饰)进行细胞感染的研究。最初研究者通过沉默宿主细胞的RNA甲基化酶和去甲基化酶,发现m6A修饰可在不影响HCV基因组复制和蛋白质翻译的条件下降低HCV病毒颗粒的产生[9]。研究发现,该过程通过YTHDF蛋白(YTHDF1、YTHDF2、YTHDF3)介导;HCV基因组中E1区域m6A修饰峰值区位点突变而无法发生甲基化修饰时,HCV病毒颗粒滴度增加[9]。Siddiqui和Kim等人发现,HCV RNA 3’-NTR经m6A修饰后,可与YTHDF2结合,影响模式识别受体RIG-Ⅰ对RNA的识别,减弱宿主的固有免疫反应,以实现HCV发生免疫逃逸,造成HCV慢性感染[21];HCV 5’端IRES区域的m6A修饰则可以通过与YTHDC2相互作用,调控RNA的翻译[20]。
综合上述研究,HCV基因组m6A修饰的具体功能与其修饰的位点存在密切关系,不同位点的修饰对HCV RNA的生物学活性影响不同。目前相关研究报道的HCV RNA m6A修饰位点对于HCV基因组19个m6A修饰高频区域覆盖率还较低,HCV RNA的m6A修饰对其生物合成的作用值得深入探索。
病毒感染细胞后,细胞特定mRNA甲基化程度发生改变,影响细胞代谢,调控病毒感染。研究者分别检测了HCV、WNV、ZIKV、DENV等4种黄病毒科病毒感染细胞的RNA丰度与甲基化水平,发现感染后RNA整体m6A修饰占所有腺苷比例、参与m6A修饰的各类蛋白表达均无明显变化[22],但病毒感染前后特定的宿主基因m6A修饰情况有所不同,该研究共检测到10891个基因、25852个外显子片段的m6A修饰水平相比对照组出现改变[22]。
将10891个基因输入Reactome 信号通路数据库进行通路分析,536个基因被标注为参与“感染性疾病”,465种基因参与“适应性免疫系统”,569种基因参与“固有免疫系统”,635种基因参与“细胞应激反应”,131种基因参与“细胞衰老”,113种基因参与“自噬”,982种基因参与“蛋白翻译后修饰”,534种基因参与“RNA代谢”。HCV、ZIKV、DENV、WNV等4种病毒感染均可引起RNA甲基化水平变化的基因有51种(表1),共包含58个甲基化峰值区。将51个基因输入Reactome 信号通路数据库进行通路分析,可归类为转录调节、免疫反应、小分子转运、翻译后修饰和细胞应激反应等通路中(表1),对这些基因m6A修饰的进一步研究有助于我们理解黄病毒与宿主细胞相互作用的共同机制。

表1. HCV、WNV、ZIKV、DENV感染细胞内m6A甲基化修饰发生变化的共同基因
(表源:Ge, et al., Virology, 2023)
与其他黄病毒相比,HCV感染最重要的特征是慢性感染和肿瘤发生。在HCV感染的细胞中筛选出45个具有m6A修饰改变的独特基因[22],部分基因与HCC相关(表2)。WTAP是构成m6A甲基转移酶复合物的必要成分,在HCC中高表达,并促进癌症发展。CAND1和HKDC1促进HCC发展。LPAR6调节HCC细胞代谢转换,与索拉非尼耐药性形成相关。ZNF207作为免疫抑制因子,帮助HCC细胞逃避免疫监测。肿瘤抑制因子,如在HCC发展中发挥抗肿瘤作用的MTAP和PCDH17,在HCV感染细胞中也发生了m6A修饰改变。除了细胞转录产物外,长链非编码RNA如促进HCC发生发展的OIP5-AS1 m6A修饰也检测到改变。HCV诱导的以上基因m6A修饰的变化可能导致这些基因的选择性表达,m6A修饰调节HCV慢性感染和HCC发展的分子机制值得进一步研究。
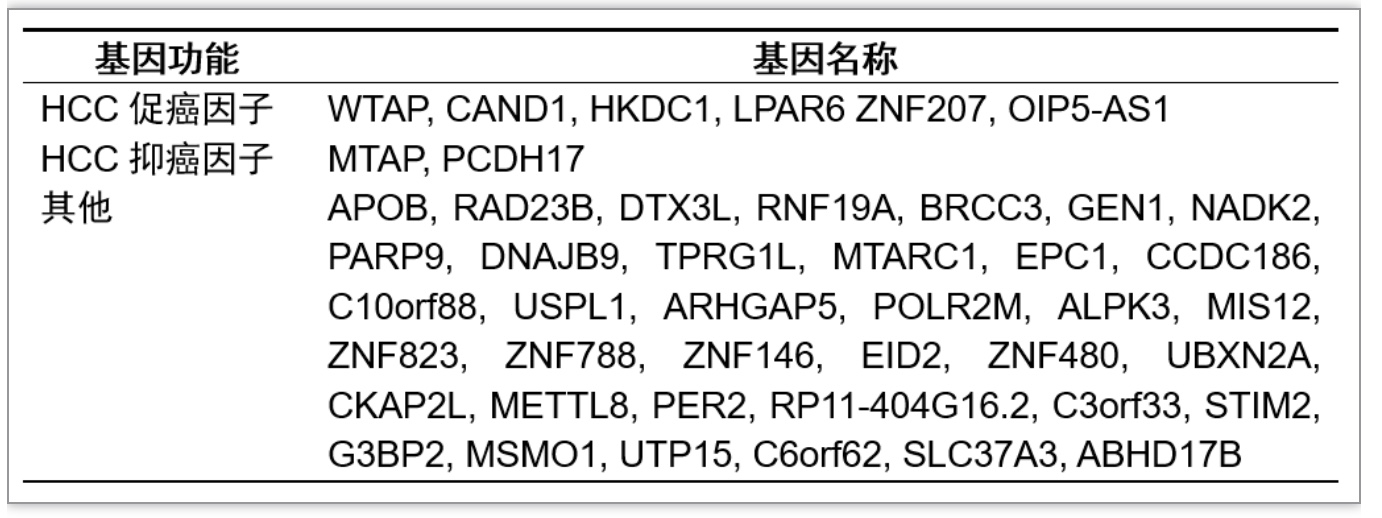
表2. HCV感染细胞内m6A甲基化修饰发生变化的特异性基因
(表源:Ge, et al., Virology, 2023)
科研人员在后续研究中选择了RIOK3和CIRBP两个基因深入研究。RIOK3属丝/苏氨酸蛋白激酶,是重要的抗病毒蛋白,可影响MDA5蛋白的组装以及TBK1和IRF3的相互作用,调控干扰素合成和固有免疫反应[23-24]。RIOK3 RNA在3’-NTR内有甲基化修饰峰值区,HCV感染细胞内RIOK3 RNA m6A修饰增强,RIOK3蛋白翻译增加,对HCV复制有明显抑制作用,降低了HCV感染性病毒颗粒的产生[22]。CIRBP在应激条件下从细胞核转移到细胞质,与细胞转录产物结合使其保持稳定,促进RNA翻译,在应激反应中对细胞起保护作用[25]。CIRBP mRNA m6A峰值区位于编码区最后一个外显子处,CIRBP mRNA可通过选择性剪接产生两种异构体(CIRBP-S、CIRBP-L),CIRBP mRNA m6A修饰减弱调节选择性剪接,抑制CIRBP-L产生[22]。HCV感染细胞内CIRBP m6A修饰减弱,沉默该基因及其各种异构体后均可抑制HCV感染性病毒颗粒产生[22],CIRBP mRNA选择性剪接对病毒感染的具体机制还有待阐明。
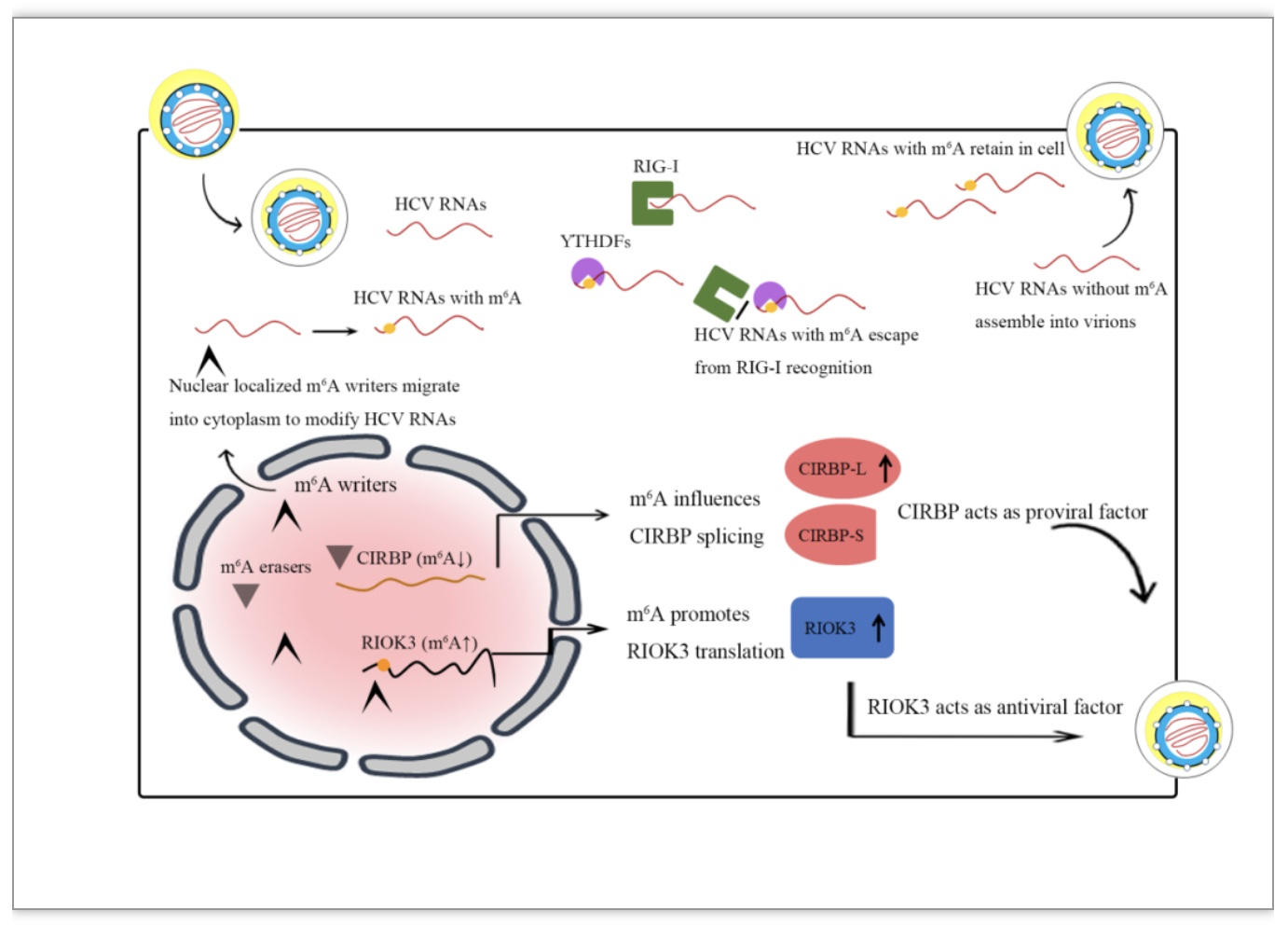
图1. RNA m6A修饰在HCV感染中的作用
(图源:Ge, et al., Virology, 2023)
m6A修饰作为近年来研究的新兴热点,其在RNA的转录后调节中的作用逐渐受到关注。m6A修饰是目前发现真核生物中最丰富的RNA修饰形式,越来越多的证据表明其对于病毒感染有重要的调节作用。HCV作为基因组长达9.6kb的单正链RNA病毒,其感染细胞后可能发生复杂的RNA修饰机制,以m6A修饰机制为例:一方面宿主细胞的m6A修饰系统可直接作用于病毒RNA,通过RNA m6A结合蛋白调控病毒RNA的翻译、病毒RNA被免疫系统的识别、病毒颗粒的组装等病毒生物学机制;另一方面,病毒感染细胞通过固有免疫应答以及应激等途径调节宿主细胞内多种基因转录产物的m6A修饰,影响RNA的翻译、稳定性以及剪接过程,最终影响细胞代谢,产生抗病毒或促进病毒感染等作用(图1)。目前对于m6A修饰如何影响病毒感染的了解还相对不足。HCV感染后引起的病毒和细胞RNA m6A修饰的具体功能尚未完全阐明,明确被修饰的RNA种类、RNA修饰位点、获取RNA修饰信号的reader蛋白种类、RNA修饰动态发生与HCV生物合成的交互作用、RNA修饰介导的细胞生物学机制,都可为后续研究RNA化学修饰对病毒感染的作用机制提供研究思路,并为探索新的抗病毒治疗提供新的靶点。

