免疫细胞培养的六个基本流程:样本制备、细胞分选、分型鉴定、扩增&培养、质量优化、后续研究。小优已经给大家详细介绍了前5个部分(可以在合集里查看往期内容噢),今天我们继续一起学习最后一个部分后续研究的相关知识。
后续研究
后续研究(Follow-Up Study):运用流式细胞术、ELISA、细胞共培养等实验技术研究免疫细胞的功能(杀伤能力、分泌细胞因子、吞噬功能、增殖能力等)。
免疫细胞可以做的后续研究实在是太多了,比如:CAR-T/NK/M,肿瘤细胞与免疫细胞共培养、类器官免疫共培养,细胞因子风暴等等,小优在这里抛砖引玉,给大家介绍3个免疫细胞研究的热门思路:NK细胞杀伤能力鉴定、混合淋巴细胞反应、Treg体外抑制实验。
后续研究(Follow-Up Study):运用流式细胞术、ELISA、细胞共培养等实验技术研究免疫细胞的功能(杀伤能力、分泌细胞因子、吞噬功能、增殖能力等)。
免疫细胞可以做的后续研究实在是太多了,比如:CAR-T/NK/M,肿瘤细胞与免疫细胞共培养、类器官免疫共培养,细胞因子风暴等等,小优在这里抛砖引玉,给大家介绍3个免疫细胞研究的热门思路:NK细胞杀伤能力鉴定、混合淋巴细胞反应、Treg体外抑制实验。
NK细胞杀伤能力鉴定
NK作为自带免疫记忆的自然杀伤细胞,对其杀伤功能的研究也是十分火热。NK细胞主要通过以下四个途径杀伤靶细胞:①NK细胞脱颗粒,释放穿孔素和颗粒酶杀伤靶细胞;②活化的NK细胞通过释放细胞因子来杀伤靶细胞;③通过死亡受体如Fas/FasL和TNF-α/TNFR-1途径诱导靶细胞凋亡;④介导ADCC作用杀伤靶细胞[1]。

体外研究NK细胞杀伤功能主要是将NK细胞与靶细胞(通常是K562细胞)共培养,然后通过检测靶细胞释放的酶或者用CAM、CFSE标记靶细胞,通过检测荧光,也可以通过MTT/CCK8检测细胞数量,从而得出NK细胞的杀伤活性,也可以检测NK细胞分泌的细胞因子或者脱颗粒指标CD107a。当然我们可以换成其他的免疫细胞和肿瘤细胞进行共培养。
小优也给大家整理了步骤可以参考[2]:
1. 将用荧光染料GFP,CFSE标记的靶细胞(一般为肿瘤细胞)接种到96孔板中,不同肿瘤细胞的接种密度可以参考图2;

2. 第二天,将培养基更换成NK细胞的培养体系,并按照靶细胞和效应细胞(NK)1:3的比例加入NK细胞,0-12h分别进行荧光显微镜拍照;
注意:靶细胞和效应细胞的共培养比例以及时间均需要通过预实验确定


混合淋巴细胞反应(MLR)
混合淋巴细胞反应(Mixed Lymphocyte Reaction, MLR)也称作混合淋巴细胞培养,是指在抗原提呈细胞刺激下,T细胞发生增殖和活化,根据淋巴细胞反应的强度来评价组织相容性抗原差异和对异体细胞的反应能力。可以分为双向混合淋巴细胞培养、单向混合淋巴细胞培养。体外研究中,通常也会检测T细胞分泌的细胞因子如IFN-γ、T细胞增殖抗原CD107a。
双向混合淋巴细胞培养:将来自两个不同供体的 PBMC 共培养,使来自两个供体的T细胞发生双向活化。
单向混合淋巴细胞培养:将从一个供体分离的 CD4+T细胞与从另一个供体分离的DC相结合,从而使 T 细胞发生单向活化。
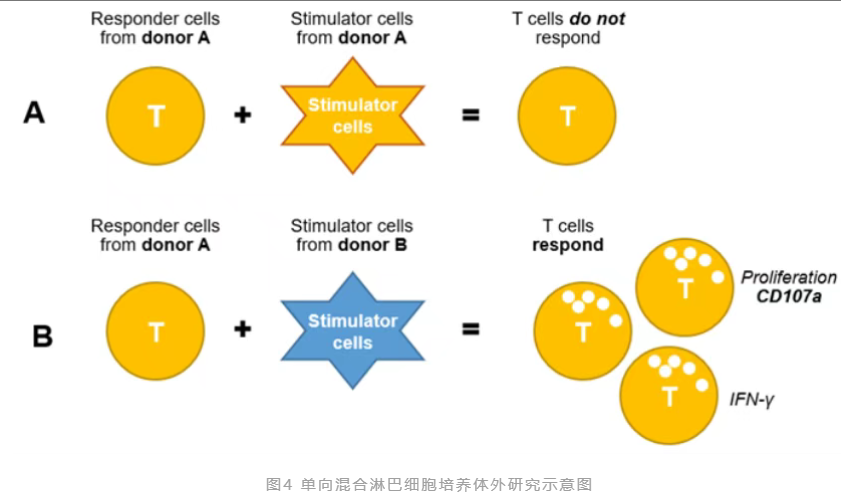
小优以单向混合淋巴细胞培养为例给大家介绍实验步骤[3]:
1. 用50 μg/ml 的丝裂霉素37℃处理来自供体B的PBMCs 30min,这些细胞作为刺激细胞;
2. 300×g离心5min,去除丝裂霉素,按照2x106个PBMCs/ml(或者磁珠分选出DC细胞)接种到24孔板(250uL)中;
3. 再加入250uL来自供A的个PBMCs(2x106cells/ml)(或者磁珠分选出T细胞),作为应答细胞;
4. 将刺激细胞和应答细胞构成的MLR置于37℃,5%CO2培养箱中培养七天;
5. 7天后可以检测应答细胞的增殖和细胞因子的分泌情况。

CD4+CD25+Treg和CD8+T体外抑制实验
体外抑制实验的优势在于,因为只有Tresp细胞(CD4+CD25-)或Treg细胞与免疫细胞共培养,所以可以直接评估Treg细胞对CD8+T细胞反应的抑制作用。
除CD8+T细胞外,也可以通过改变实验条件来评估Treg细胞对其它免疫细胞(如树突状细胞或自然杀伤细胞)的影响。
小优也给大家整理了文献中的实验步骤,可以作为参考[4]:
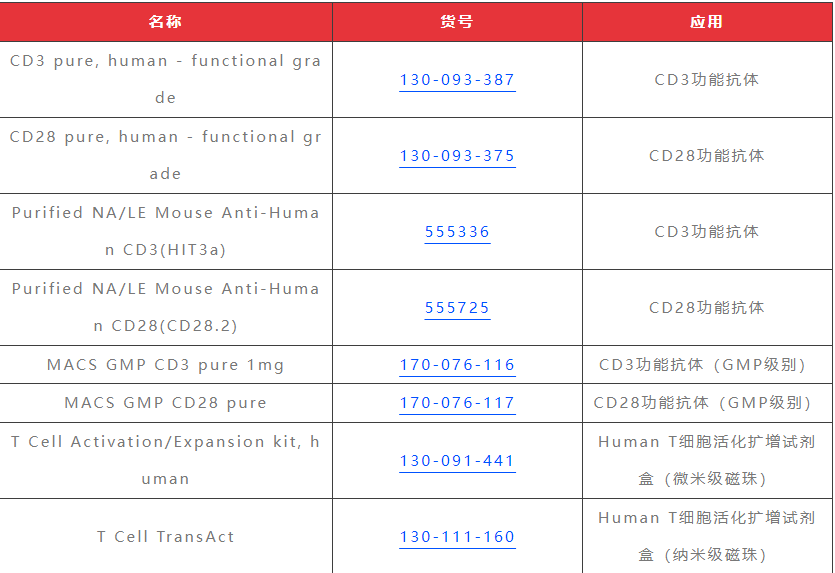
1. 为了制备anti-CD3/CD28包被的磁珠:将适当体积的磁珠转移到15ml管中(2.5μl/1x105 cells)。加入等体积的PBS并混合。4°C,300g离心2min,丢弃上清液。在完全培养基中稀释磁珠(50μl/孔);
2. 取50μl CD4+CD25+Treg细胞(1×105 cells/孔)。每孔加50μl CD8+T细胞作为应答T (Tresp)细胞(1×105 cells/孔)。每孔加入50μl稀释后的anti-CD3/CD28;
注意:在此步骤中,标记和建立对照孔如下:未刺激CD8+T(不含anti-CD3/CD28);刺激的CD8+T细胞(含anti-CD3/CD28);刺激的Treg细胞(含anti-CD3/CD28)。Treg细胞可以用完全培养基稀释,以不同比例的Tresp细胞与Treg细胞(1:0.25-1:1)共培养;
3. 各孔加50μl或适当体积的培养基,总体积为200μl。用铝箔盖住板子,放入二氧化碳培养箱中37°C培养 72h;
4. 培养72h后进行细胞因子产生分析,将每孔上清液分离到另一个板上,进行酶联免疫吸附试验(ELISA),检测IFN-γ水平;
5. 将每孔上清液分离后,用FACS缓冲液清洗含有细胞的培养皿,4°C,300g离心2min,洗3次;
6. 洗涤后,弃去上清。用50 μl的抗体缓冲液(anti-CD4、anti-CD8和细胞活力检测试剂)重悬细胞,对增殖的CD8+T细胞进行染色(在获得CD8+T细胞时,可使用追踪细胞增殖的染料进行标记)。4°C避光孵育20min;
7. 4°C,300g离心2min,洗两次。洗涤后,弃上清,用100μl固定缓冲液4℃避光固定20 min;
8. 4°C,300g离心2min,洗两次。200μl FACS缓冲液重悬细胞,流式细胞术检测标记CD8+T细胞增殖情况。

参考文献:
1.Cheent, K. and S.I. Khakoo, Natural killer cells and hepatitis C: action and reaction. Gut, 2010. 60(2): p. 268-278.
2.<TheImmunologicalSynapse_Full978-0-323-90154-3.pdf>
3.Pissas, G. and T. Eleftheriadis, Assessment of Humoral Alloimmunity in Mixed Lymphocyte Reaction. Bio-Protocol, 2019. 9(2).
4.Ha, S.-J., J.H. Oh, and H.J. Park, Phenotypic and Functional Analysis of Activated Regulatory T Cells Isolated from Chronic Lymphocytic Choriomeningitis Virus-infected Mice. Journal of Visualized Experiments, 2016(112).
5.Park, H.J., et al., PD-1 Upregulated on Regulatory T Cells during Chronic Virus Infection Enhances the Suppression of CD8+ T Cell Immune Response via the Interaction with PD-L1 Expressed on CD8+ T Cells. The Journal of Immunology, 2015. 194(12): p. 5801-5811.
好啦,免疫细胞培养的六个流程都给小伙伴们介绍完了,相信大家关于免疫细胞的培养和研究一定蒸蒸日上,如果还有什么疑问的话,可以添加文末小助手的微信,加入优宁维细胞一站式互助Club进行交流。

目前优宁维已开通官方WB、细胞、蛋白纯化、Biacore、多因子及多组学互助交流群,扫码添加优宁维实验小助理微信,发送您的单位、姓名及想要加入的社群名称即可入群,群内可抢先获知小优大学堂精彩课程表,还可获得各种实用的实验Tips,享受技术专家在线答疑,并且还有不定期的专属群福利,赶紧来加入吧!

