线粒体与溶酶体之间的协调相互作用是维持细胞生命活动所必需的,主要表现为线粒体自噬、线粒体衍生的囊泡和直接的物理接触(酵母液泡-线粒体接触斑块,vacuolar and mitochondrial patches,vCLAMPs;哺乳动物线粒体-溶酶体接触位点,mitochondria and lysosome contacts,MLCs[1, 2])。同型融合和蛋白质分选复合物(homotypic fusion and protein sorting,HOPS)的VPS39亚基在细胞器动力学调控中发挥关键作用,如内体-溶酶体运输和线粒体-液泡/溶酶体相互作用的串扰,从而影响多种生理功能。另外,VPS39及其相关亚基的异常表达被报道参与了一些疾病的病理过程。因此,探究VPS39在调控细胞器动力学,进而调控生理功能以及参与疾病发生的潜在机制,以期为发现线粒体和溶酶体疾病的治疗靶点提供新的线索。
作者首先介绍了VPS39蛋白的功能结构域以及与其他VPS家族亚基的结构位点,以总结HOPS复合物在内体运输中发挥的转运调控。随后分析了VPS39对于“两种形式”线粒体和溶酶体相互作用的干扰,提出VPS39可能参与内吞体运输与线粒体自噬之间的串扰。最后作者综述了VPS39参与多种疾病并且均参与以上亚细胞器的异常运输的证据,证明了VPS39在生理和疾病中的关键作用。
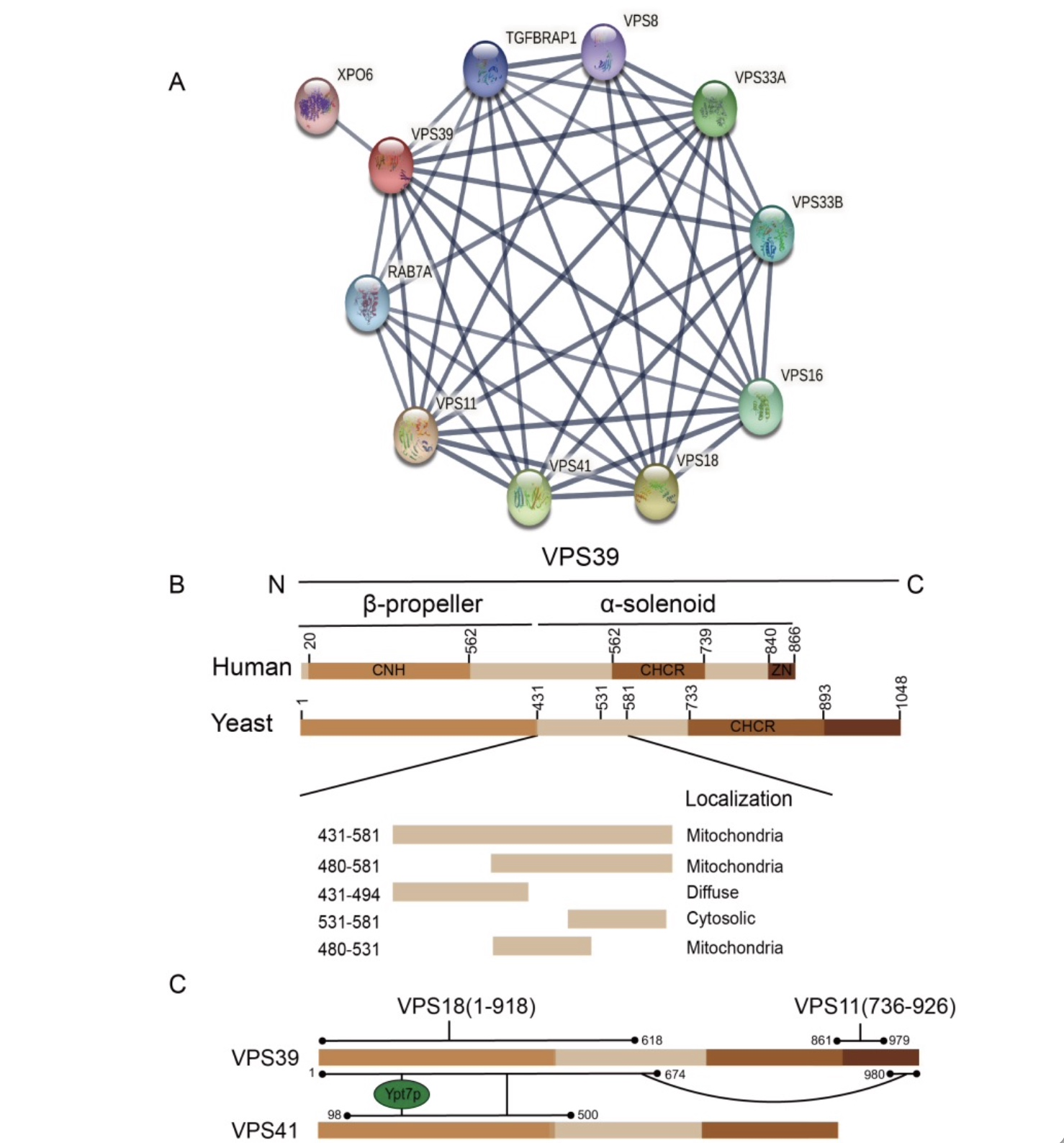
VPS39/vam6/TLP编码一种由1049个氨基酸组成(图1)的亲水性蛋白,与VPS家族Class B的VPS41以及与Class C的所有VPS亚基组成HOPS复合物,参与内体/囊泡的运输。在酵母中,HOPS的突变导致同型和异型晚期内体/自噬体与溶酶体融合[3]的破坏,从而导致溶酶体聚集或疾病。酵母无需依靠内吞转运机制生存。相反,在高等真核生物中相关基因的功能缺失突变会导致死亡。特别是,VPS39/TLP缺失抑制转录,同源重组修复失活和双链断裂(DSBs)积累,最终导致细胞凋亡。VPS39在纯两性畸形中导致敲除后6.5周内胚胎死亡。VPS39/TLP基因敲除斑马鱼模型中,出现的一系列疾病的发生可能是因为受到VPS39/TLP对内体运输影响的刺激而产生。事实上,单一亚单位VPS39的动力学也可能调节HOPS功能。作者综述了与VPS39相互作用的其他亚基结构位点(图1),为了解该蛋白在亚细胞器之间发挥的功能作用提供参考。
(图源:Li, Hanbing et al. Journal of cellular biochemistry, 2023)
内吞转运是运输蛋白质等或将物质降解的过程,通过形成早期(蛋白质循环)内体到晚期内体/溶酶体/液泡来完成。其中待回收的蛋白质等经分拣后通过回收循环通路回收利用。而待降解的蛋白质或物质通过早期和晚期内体转移到液泡/溶酶体后,溶酶体进一步与自噬小体融合形成自噬溶酶体,达到降解的目的。
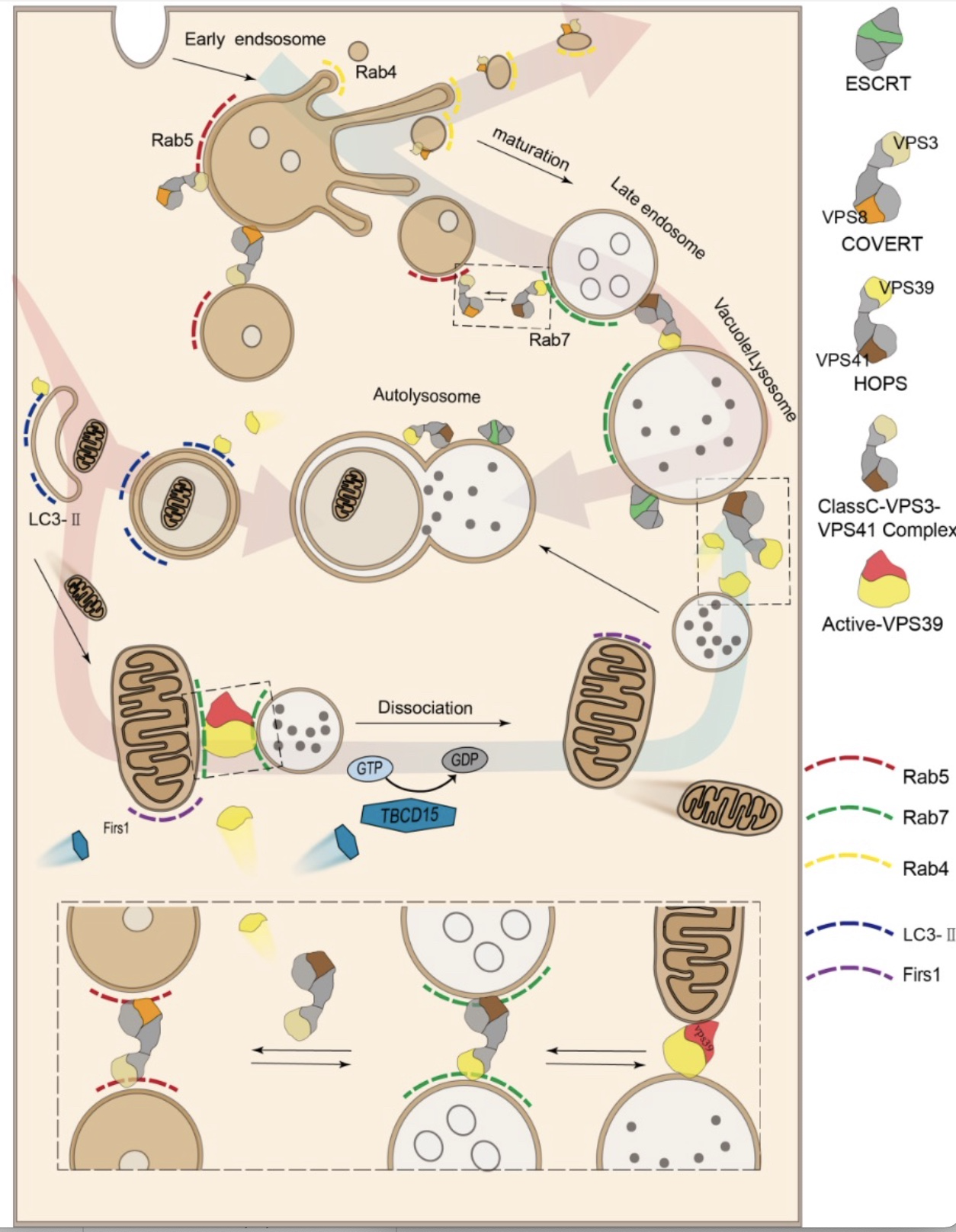
VPS39作为HOPS复合物的重要成员,参与内体运输的过程(图2):包括(1)内体与内体/溶酶体的融合;(2)同型溶酶体和异型溶酶体之间的栓系;同型溶酶体之间的融合;(3)晚期内体和自噬体/自噬溶酶体之间的异型融合。
目前,线粒体与液泡/溶酶体之间的相互作用主要有三种形式,其中两种涉及VPS39(图2)。一种是VPS39亚基独立于HOPS复合物,单独参与酵母中线粒体与液泡之间物理膜接触位点(vCLAMPs[4])并形成复合物TOM40-VPS39-Ypt7。vCLAMPs富集离子和氨基酸转运蛋白,在内体系统和线粒体之间的脂质转运中发挥作用。vCLAMPs和HOPS会争夺同一个VPS39池(图1)。HOPS和核心液泡和内体栓系复合物(Class C core vacuole endosome tethering,CORVET)的动态组装效应使CORVET的VPS3亚基在HOPS中占据VPS39的位置,并形成新的亚复合物(图1)。说明VPS39亚基在新亚复合体进行栓系和融合的情况下参与了其他功能。VPS39与其他VPS亚基的相互作用也能干扰vCLAMPs的形成。例如VPS11过表达诱导VPS39在液泡中大量聚集并倾向于形成VPS9-VPS11亚复合体,并消除vCLAMPs结构的积累。VPS39是否存在和调控哺乳动物MLCs虽然还没有被明确证明。
另一种是VPS39调节自噬通量和自噬溶酶体的形成,从而影响线粒体自噬。线粒体经过分裂和衰老产生MDVs/MDCs,并与应激线粒体发生线粒体自噬,以调节线粒体数量并维持其功能。VPS39调控自噬通量与其参与内体/自噬体和[3]自噬溶酶体的形成有关。Vam6Δ/Δ突变体阻止了液泡和自噬体在氮饥饿条件下的融合,抑制了细胞质向液泡靶向和非选择性自噬途径的转变。在OXPHOS缺陷细胞中,鞘氨醇1磷酸酯裂解酶(SPL-1/SGPL1)的上调刺激VPS39募集到线粒体,从而增强MLCs以促进线粒体质量控制。在线粒体钙摄取蛋白1(MICU1)缺陷细胞中,VPS39下调始终影响线粒体网络的维持和基础自噬通量。
最后一种是在特殊情况下,线粒体被溶酶体直接吞噬形成杂合子细胞器(线粒溶酶体),执行特定的生理功能,本文不赘述。
3.VPS39参与内吞/vCLAMPs/自噬的串扰过程
VPS39可能直接影响HOPS复合体功能和溶酶体动力学。因此,内体和自噬溶酶体的形成以及线粒体和液泡/溶酶体的相互作用存在负反馈机制。另外,COVERT和HOPS的动态组合可能会干扰VPS39池,从而影响vCLAMPs的形成。虚线框表示复合物与单体之间的动态串扰过程(图2)。CORVET的VPS3子基可以在HOPS中占据VPS39的位置。形成一个新的复杂的ClassC-VPS3-VPS41行使部分HOPS栓系功能,并允许VPS39参与vCLAMPs膜接触位点。
在哺乳动物[5]中,线粒体自噬和内吞作用是相互依赖的。自噬的成熟依赖于内体-溶酶体运输的交叉和融合。相反,线粒体自噬影响细胞的内吞作用和信号转导,甚至强烈干扰内体-溶酶体运输异常相关疾病的发生。综上所述,VPS39不但在内体-溶酶体运输中发挥重要的作用,而且在线粒体-液泡/溶酶体相互作用中更是必不可少的桥梁。了解VPS39在亚细胞细胞器内的运输机制对于理解疾病的发生至关重要。
图2 VPS39参与内溶酶体转运和线粒体与溶酶体相互作用的调控
(图源:Li, Hanbing et al. Journal of cellular biochemistry, 2023)
三、在某些疾病的发病机制中涉及VPS39以及细胞器互作的串扰
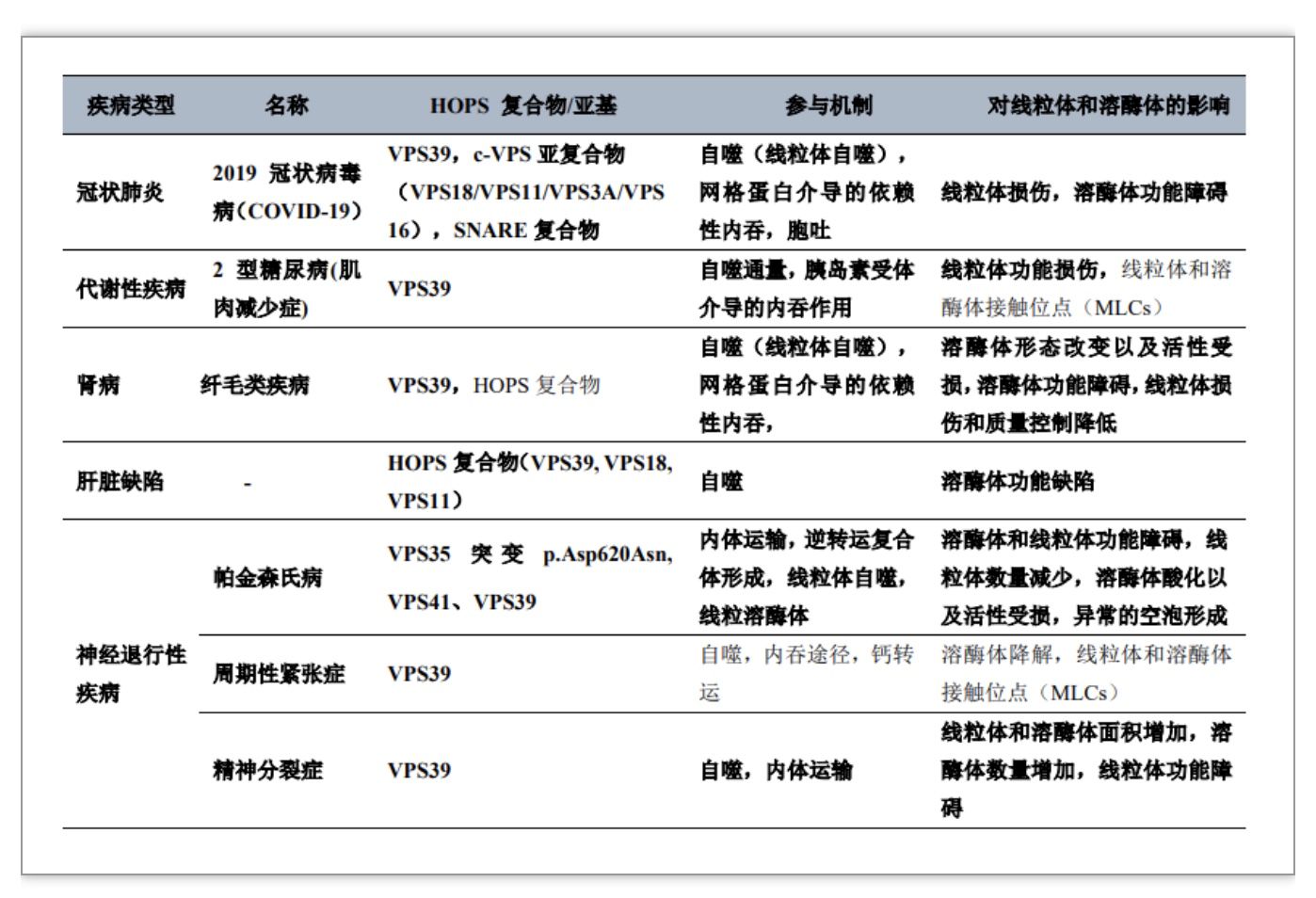
迄今为止,还没有因VPS39基因的致病变异而导致人类疾病的报道,但它类似于由内体囊泡异常转运引起的人类多系统疾病[6]。以下疾病表现出细胞器功能受损以及内体转运和自噬之间的互补关系(表1),因此这两个细胞器之间的异常通信是疾病的根本原因。值得注意的是,一些HOPS复合物亚基的突变以及VPS39与这些亚基之间的动态变化也有助于疾病的发生。
注:明确参与疾病的加粗,参考文献详见原文,有可能/假说的不加粗。
(表源:Li, Hanbing et al. Journal of cellular biochemistry, 2023)
VPS39在细胞器-溶酶体接触中,个体亚基与潜在伙伴亚基相互作用的具体过程尚未得到充分的研究。了解这些栓系蛋白如何在细胞器互作的串扰中发挥作用,可以为探究VPS39在MLCs中的具体功能提供参考。VPS39在多种疾病的自噬过程中起着重要调节作用,VPS39在生理条件下如何调节线粒体和溶酶体的定位和功能、以及突变条件下如何导致疾病等机理,还需进一步的研究。
同样值得关注的是亚细胞细胞器串扰研究中的困难。由于单个亚基可能不会形成稳定的膜栓系复合物,因此不容易通过生化手段检测到它们。细胞、小鼠和其他模型系统中的特定基因编辑方法可能有助于将突变与疾病发病机制联系起来。此外,实现长时程超分辨成像来探索动态细胞器相互作用对诊断疾病和靶向药物治疗的干预反应具有重要意义。