随着表观遗传学的迅速发展,DNA甲基化作为重要的表观遗传修饰方式之一,在基因表达调控、细胞分化、发育及疾病发生中扮演着关键角色。RRBS(简化全基因组DNA甲基化测序)技术作为一种高效、经济且高分辨率的DNA甲基化研究方法,在近年来受到了广泛关注。相信很多小伙伴对于这个技术还不是很了解,那我们就一起通过本文初识RRBS技术吧。
什么是RRBS
简化全基因组DNA甲基化测序(Reduced Representation Bisulfite Sequencing, RRBS)是指利用限制性内切酶对基因组进行酶切,富集启动子及CpG岛等重要的表观调控区域并进行重亚硫酸盐测序。RRBS技术结合了限制性内切酶和亚硫酸氢盐测序的优势,通过富集基因组中富含CpG区域的片段,实现基因组单核苷酸级别的甲基化水平分析。同时该技术也显著提高了高CpG区域的测序深度,在CpG岛、启动子区域和增强子元件区域可以获得高的分辨率,是一种准确、高效、经济的DNA甲基化研究方法,在大规模临床样本的研究中具有广泛的应用前景。相较WGBS,RRBS仅对基因组1%的区域进行测序,成本低,测序深度更大,数据利用率更高,但不能获得完整的全基因组甲基化信息[1]。
主要实验步骤
基因组DNA提取与检测:首先,根据不同样品类型采用相应的提取方案获取高质量的基因组DNA,并通过Qubit和琼脂糖凝胶电泳等方法检测DNA的浓度和完整性。
限制性酶切:利用限制性内切酶对基因组DNA进行酶切,富集富含CCGG位点的片段,这些位点通常位于CpG富集区域,如启动子、CpG岛等。
文库制备:对酶切后的DNA片段进行末端修复、加A尾和连接甲基化接头,然后通过电泳回收富含CpG的特定长度片段(通常为250-500 bp)。
亚硫酸氢盐转化:将回收的DNA片段进行亚硫酸氢盐处理,将未甲基化的胞嘧啶(C)转化为尿嘧啶(U),而甲基化的胞嘧啶则保持不变。
PCR扩增与纯化:对转化后的DNA片段进行PCR扩增,并纯化PCR产物,获得最终的测序文库。
高通量测序与数据分析:将文库在Illumina等平台进行高通量测序,测序完成后,对测序数据进行质控、去除接头序列和低质量序列,并与参考基因组进行比对,最终得到甲基化位点的信息并进行深入分析。
主要应用
近年来诸多研究证明DNA 甲基化与疾病发生发展间的关系密切,为疾病的机制研究提供了新的方向和理论指导[2]。RRBS技术因其高性价比和高分辨率的特点,在多个领域具有广泛的应用价值。
癌症研究:RRBS在肿瘤生物学研究中具有显著优势。通过比较肿瘤样本与正常样本的甲基化差异,可以识别潜在的癌症驱动基因或抑癌基因,揭示肿瘤发生和发展过程中的甲基化变化。例如,在乳腺癌研究中,RRBS技术被用于绘制乳腺癌组织和相邻正常组织的DNA甲基化图谱,揭示了与乳腺癌形成和进展相关的甲基化机制。
发育和分化研究:RRBS可用于探究细胞分化和发育过程中基因启动子和调控区域的甲基化模式变化,从而理解甲基化在细胞进化中的作用。例如,在研究肠道功能适应早产环境的过程中,RRBS揭示了早产猪肠道基因DNA甲基化的重编程。
环境和遗传因素研究:RRBS可用于研究环境和遗传因素对甲基化的影响。通过比较不同环境条件或不同个体间的甲基化水平,可以揭示环境和遗传因素在基因表达调控中的作用。
表观遗传学研究:RRBS在表观遗传学领域具有重要作用,可帮助研究人员探索甲基化如何影响基因表达、遗传稳定性和表观记忆。
药物开发和筛选:RRBS可用于评估药物对甲基化的影响,指导药物研发和治疗策略的制定。通过了解药物对特定基因区域甲基化状态的影响,可以优化药物设计,提高治疗效果。
相信大家一定对RRBS的介绍感到意犹未尽,那么接下就通过一篇文章来一起看一下RRBS到底可以帮助我们解决什么问题吧。
文献解读
奥运在巴黎如火如荼得开展,中国奥运健儿在赛场拼金夺银,想必平常疏于锻炼的打工人近期受到奥运精神的感染,将减肥计划又一次提上了日程。是的,锻炼的好处无需多言,可以减重,让身体更健康,提升自信,更有可能在减缓衰老方面带来意想不到的效果,想想平时那些经常锻炼的老年人,是不是看起来比同龄人要年轻,而这确实是有科学研究数据支撑的,如下文章我们一起来看看。
引用文献:
Murach, K. A., Dimet- Wiley, A. L., Wen, Y., Brightwell, C. R., Latham, C. M., Dungan, C. M., Fry, C. S., & Watowich, S. J. (2022). Late- life exercise mitigates skeletal muscle epigenetic aging. Aging Cell, 21, e13527. https://doi. org/10.1111/acel.13527
摘要:
肌肉锻炼会带来很多好处,即便是晚年也一样,但表观遗传对晚年锻炼适应过程贡献有多大还不清楚。利用简化基因组甲基化测序(RRBS),核糖体DNA和线粒体特异的甲基化检测,靶向高分辨率甲基化分析,基于小鼠耐力/阻力训练(渐近加权轮跑PoWeR)模型的DNAge 表观衰老时钟分析,我们发现锻炼会减缓肌肉组织的表观衰老。22-24 月龄晚年小鼠的PoWeR显著减缓了年龄相关基因启动子区域的高甲基化。PoWeR训练8周的老年鼠的肌肉表观年龄比缺乏锻炼的对照组年轻了8周(~8%的小鼠寿命)。这个数据为减缓肌肉衰老提供了分子基础。
随着时间流逝,各组织器官会经历DNA甲基化的改变,这也是导致机体结构和功能衰退的原因之一。锻炼会改变肌肉DNA的甲基化,但是是否会让老龄的小鼠骨骼肌甲基化组跟年轻小鼠更相似还不太清楚。对22-24月龄的老龄小鼠进行高强度的滚轮锻炼(PoWeR处理组),训练后,利用RRBS,靶向高分辨率分析,组织特异性CpG位点分析确定锻炼是如何影响表观衰老的。
实验设计:
1. 取材:久坐不动的老龄鼠(24个月);久坐不动的年轻小鼠(4个月);PoWeR训练的老龄鼠(22月龄后处理8周),每组5个样;
2. 实验方法:取骨骼肌样本,QIAamp DNA提取核DNA,进行RRBS检测(Msp1酶切, PE150测序);
3. 分析方法:质控后reads跟小鼠基因组(GRCm39版本)比对同时增加rDNA序列比对(比对软件:Bismark 0.19.0), 组间差异甲基化分析使用MethylSig v1.0.0软件(甲基化位点深度至少10×)。Promoter区定义为转录起始位点上游1kb,计算Promoter区甲基化差异。CpG位点根据NCBI 给出的染色体位置进行基因注释。
实验结果:
1. 三个观察组在启动子区域CpG位点甲基化水平变化。
(1)跟年轻小鼠相比,老龄鼠中103个启动子区域CpG位点(对应9个基因)是显著低甲基化的(hypomethylated),而762个CpG位点(对应133个基因)都是显著高甲基化的(hypermethylated)。对显著高甲基化区域的基因进行功能富集分析显示集中在三羧酸循环(TCA)途径,尤其是NAD活性相关的基因。外显子和内含子也表现出类似的趋势(即随着年龄增加,甲基化水平会增加)。
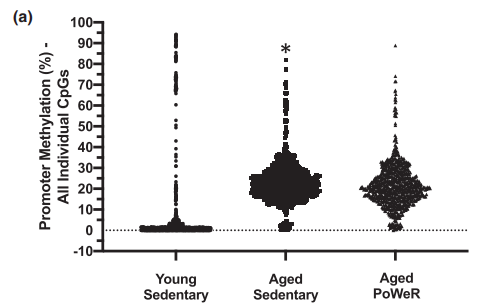
图1a.老龄小鼠和年轻小鼠(均不运动)启动子区域CpGs甲基化水平分布图
两组比较差异显著,*FDR<0.05,将差异位点对应在老龄运动小鼠中的也一并展示。
(2)跟年轻小鼠相比,老龄小鼠启动子区域显著低甲基化的5个基因(对应6个CpG位点)在PoWeR组中并未显著降低;同样的,18个启动子区域显著高甲基化的基因(对应29CpG位点)在PoWeR组并未显著增加。
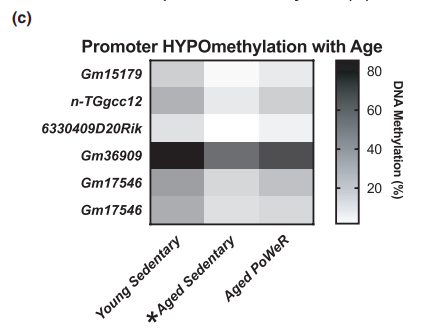
图1c. 跟年轻小鼠相比,老龄鼠中启动子区域显著低甲基化的基因(*FDR<0.05),但在训练老龄鼠中并未低甲基化。
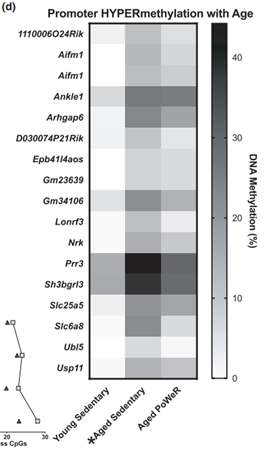
图1d.跟年轻小鼠相比,老龄鼠中启动子区域显著高甲基化的基因(*FDR<0.05),但在训练老龄鼠中并未高甲基化。
(3)PoWeR 减缓年龄相关基因(Rbm10)启动子区域的高甲基化,同时跟Timm8a1基因启动子区域低甲基化相关。在PGC-1β敲除模型中,小鼠骨骼肌展示出线粒体功能受损和氧化应激,跟Timma8a1的低表达水平相关,缺失Timma8a1功能导致线粒体畸变。
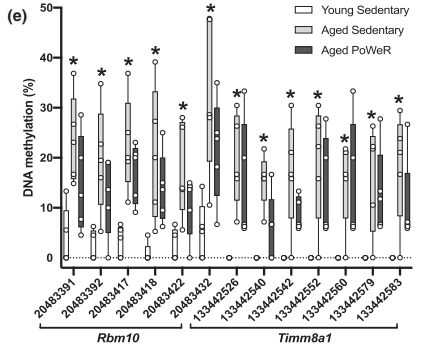
图1e.两个基因(Rbm10 和Timm8a1)启动子上游多个CpG位点在3个组甲基化水平的分布。
2. CpG岛的甲基化水平变化
转录可以被单个CpG位点或者一簇CpGs(CpG岛)调控,分析CpG岛的差异可以反映单个个体位点的差异。跟年轻小鼠相比,16个基因(对应12个CpG岛)在老龄小鼠中高甲基化,但是在PoWeR老龄组没有,不过有5个基因(对应4个CpG岛)只在PoWeR老龄组高甲基化。8个基因(对应6个CpG岛)随着年龄低甲基化了,但是PoWeR老龄组没有,这里面包含Hoxa3基因。这个基因近期被报道是肌肉中年龄相关甲基化改变的热点基因。3个基因(对应2个CpG岛)只在PoWeR老龄组低甲基化了。
3. rDNA的甲基化水平变化
rDNA的甲基化随着年龄增加,带有高保守的甲基化节律性。跟年轻小鼠相比,老龄鼠rDNA 上有360个差异CpG位点(FDR<0.05),其中15个低甲基化,345个高甲基化。9个老龄鼠中低甲基化的位点在PoWeR老龄鼠中未降低。11个老龄鼠中高甲基化的位点在PoWeR组中甲基化水平变得跟年轻组更相似。
不过高深度(平均CpG位点深度>10,000x)的特定位点分析中,CpG 43519位点的甲基化水平在PoWeR组升高,且年轻小鼠中甲基化水平也是升高的。这个结果跟fig2a中RRBS的结果不一致(RRBS 在该位点平均深度 23×)。
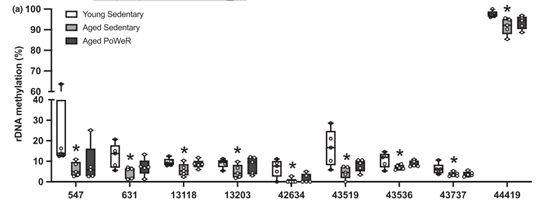
Fig2a. rDNA CpG位点差异箱线图(老龄鼠甲基化水平显著低于年轻小鼠的位点,但PoWeR组无显著差异)
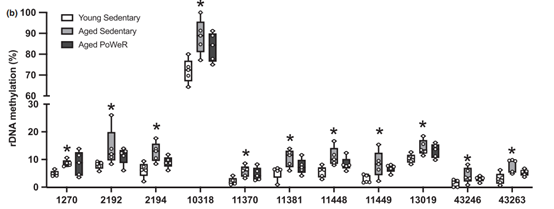
Fig2b. rDNA CpG位点差异箱线图(老龄鼠甲基化水平显著高于年轻小鼠的位点,但PoWeR组无显著差异)
综上结果可知,随着年龄增加,会出现某些显著高甲基化的位点和显著低甲基化的位点,但通过晚年锻炼,可以一定程度减缓这些位点的变化趋势。
生工生物工程(上海)股份有限公司自2011年成立高通量测序部以来,逐步引进了Illumina,Life,DNBSEQ,PacBio、Nanopore、等二代/三代测序平台。建立了2000平米高标准实验室(通过了国家ISO认证)并搭建了50PB级存储及运算能力的服务器集群,能满足绝大多数科研客户的研究需要。同时,生工高通量测序团队建设也在不断完善中,目前有100余专职员工,其中高级技术人员以及高级生物信息工程师占比50%以上,10年来,通过生工高通量测序服务所发表的文章累计影响因子在10000分以上。
生工生物现可提供简化全基因组DNA甲基化测序,感兴趣的小伙伴欢迎来电与我们技术支持沟通交流。
技术支持联系电话:021-5707 2057/2096
技术支持联系邮箱:genome@sangon.com/ genome2@sangon.com
参考文献
[1] SmithZD, Gu H, Bock C, et al. Methods, 2009, 48(3): 226.
[2] 赵智婕. DNA 甲基化与疾病的研究进展. 世界最新医学信息文摘, 2018, 18(76):95-96.
.png)

