一种新颖的方法用于腺相关病毒(AAV)衣壳蛋白和宿主细胞蛋白杂质的肽图谱分析
关键词:腺相关病毒(AAV),衣壳蛋白,肽图谱分析,宿主细胞蛋白(HCP)杂质分析,蛋白酶,SP3磁珠,液相色谱-串联质谱(LC-MS/MS)。
快速了解本篇文章介绍重点。
01概述
肽图谱分析腺相关病毒(AAV)衣壳蛋白由于其稳定的组装特性而被证明是一项挑战。虽然各种方法已显示出一定的成功,但大多数方法依赖于非特异性蛋白酶。尽管这可以导致较高的蛋白质覆盖率,但是峰的数量使得对制造批次的可靠质量控制变得复杂。鉴于此,Promega开发了一种新方法,利用优化的缓冲系统以及基于亲水性磁珠的捕获技术(SP3)。这种方法通过增加衣壳溶解和变性的选项,改善了肽图分析。类似的方法也被应用于宿主细胞蛋白(HCP)杂质的分析,并且使用一种由纯化蛋白质构成的新型混合物实现了定量分析。
02方法
01SP3 脱盐与蛋白酶解
● 将约3μg的AAV2衣壳蛋白与等量的衣壳结合缓冲液(Promega原型开发缓冲液)混合,并使用DTT和TCEP(最终浓度为20 mM)还原。
● 样品短暂加热后冷却,随后用氯乙酰胺进行烷基化处理,并加入Benzonase酶作用20分钟。
● 向样品中添加Promega的MPSP磁珠(250μg;12.5微升的20mg/mL溶液),随后加入100%乙腈至终浓度80%。
● 混混合物轻轻手动颠倒混合,然后以1000rpm振荡20分钟。
● 衣壳蛋白与磁珠结合后,移除上清液,磁珠用80%乙醇清洗三次。
● 将磁珠重新悬浮于100微升的衣壳消化缓冲液(Promega原型)中。
● 加入蛋白酶(Trypsin Platinum,Trypsin/Lys-C,Glu-C,rAsp-N或胃蛋白酶;Promega)进行酶切,比例不一,消化16小时。
● 在某些情况下,分别添加Lys-C和/或Arg-C ultra,再额外消化2小时。Arg-C ultra需要在消化缓冲液中加入1mM的TCEP。
02液相色谱-串联质谱(LC-MS/MS)
● 使用Waters柱(CSH C18 1.7mm VanGuard FIT;2.1 x 150 mm)对衣壳蛋白酶解产物进行液相色谱分离。流速设定为0.3mL/min,柱温为60°C。
● 使用UV和MS检测器进行检测监控。使缓冲液在空体积中洗脱,随后切换阀。
● UV信号监测波长为214nm。质谱分析在Thermo Exploris 240质谱仪上进行。
● 实验设置为Top 5模式,即采集一个MS1谱图后,紧接着采集五个MS/MS谱图。MS1分辨率设为60,000,隔离宽度为1.7Hz,碰撞能量为32。
● MS2 AGC设置为75%,IIT设置为自动(通常约为25μs)。
03数据分析
● 使用Biopharmafinder(Thermo)、Byos(Protein Metrics)或Mascot(Matrix Science)软件处理Thermo生成的.raw文件,以分配肽段质量和匹配MS2谱图。
● 从多个数据库获取的衣壳序列被添加到人类UniProt数据库中,以便进行FDR(错误发现率)过滤。
● 进一步分析使用Freestyle(Thermo)和Skyline(华盛顿大学)软件完成。
● 使用Scaffold 5(Proteome Software)确定序列覆盖度。
03工作流程
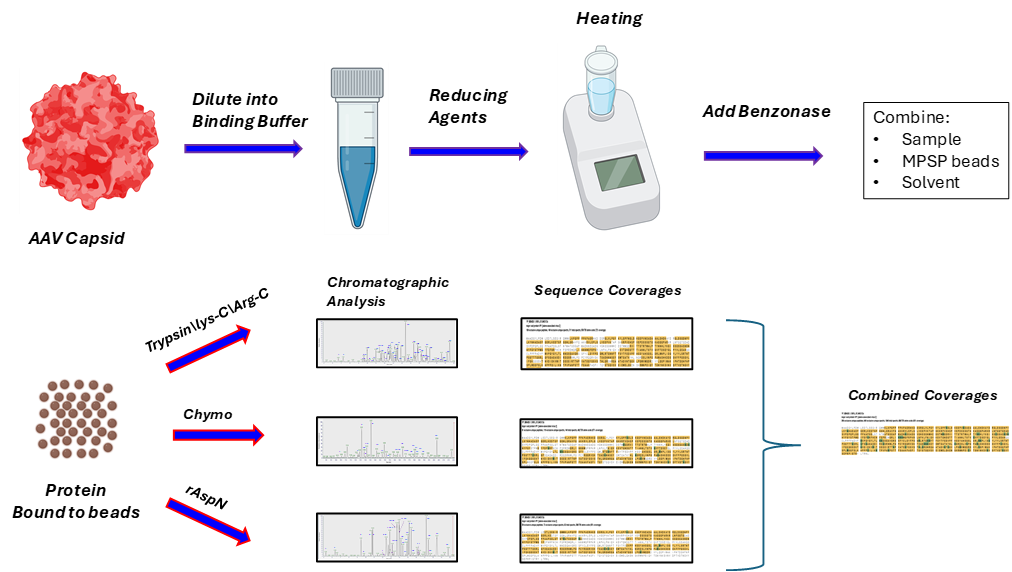
图1. 利用标准实验室设备制备高质量的、不含已知会干扰液相色谱(LC)或质谱(MS)分析的物质的样品,可以在不到1小时的实际操作时间内完成。衣壳溶液与溶解/结合缓冲液混合,在还原剂存在下加热,然后在加入磁珠和有机溶剂后进行短暂的结合步骤。经过几次简短的洗涤步骤后,加入蛋白酶并允许其过夜进行消化。肽段可以直接通过液相色谱-串联质谱(LC-MS/MS)进行分析。
04色谱分析
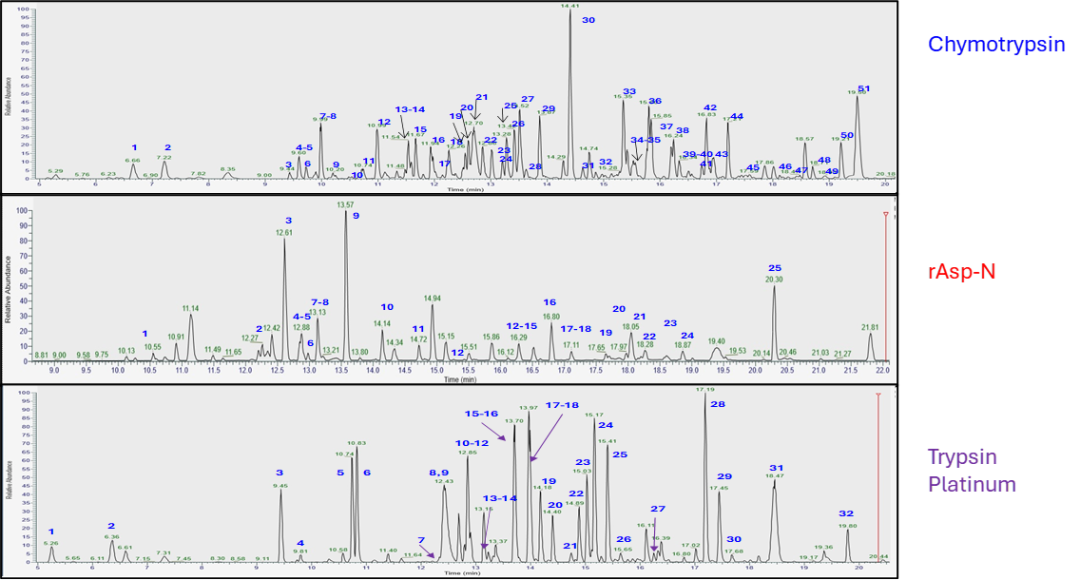
图2. AAV2蛋白酶解后的液相色谱分离。每份样品分析了大约8.5皮摩尔的物质。位点特异性的蛋白酶产生了高质量的肽段消化产物,这些产物通过超高效液相色谱(UPLC, Thermo的Vanquish系统)容易地得到分离。峰的检测同时使用了紫外检测(未显示)和基于质谱的检测。使用Byos(Protein Metrics)和Biopharmafinder(Thermo)分配峰。
05序列覆盖

图3. 对VP3蛋白(来自AAV2的全长VP蛋白)的序列覆盖度分析显示,从三种不同的位点特异性蛋白酶消化的肽段分析可以获得大量的序列信息。然而,只有将这些数据综合起来,才能获得接近完全的序列覆盖度,这突显了多酶策略的重要性。
06血清型映射
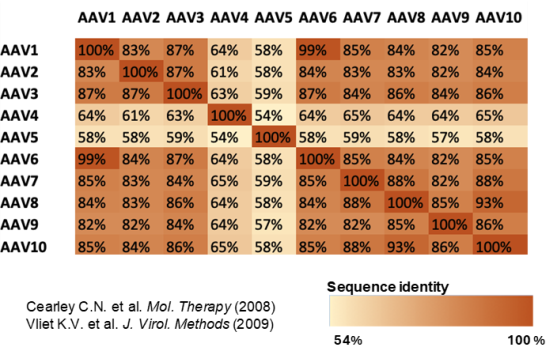
图4. 在大多数情况下,大多数AAV血清型之间的序列同一性最多约为85%。值得注意的是,仅使用Trypsin Platinum(Promega)进行蛋白酶解就足以正确识别目标血清型。这在一定程度上是因为AAV蛋白中至少存在5个独特的肽段,使得能够做出正确的鉴定。此外,仅使用胰凝乳蛋白酶的情况下,典型的覆盖度大约为80%,这对于做出正确、高置信度的血清型识别来说已经足够。
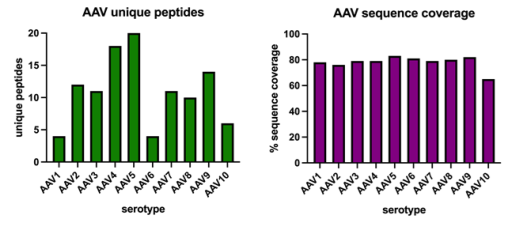
● Trypsin Platinum能够正确识别血清型。
● 在多数情况下,覆盖度高于75%。
● 在所有情况下,正确的血清型(AAV)都是最匹配的结果。
● 使用额外的蛋白酶应该能增加覆盖度和特异性。
07宿主细胞蛋白杂质分析
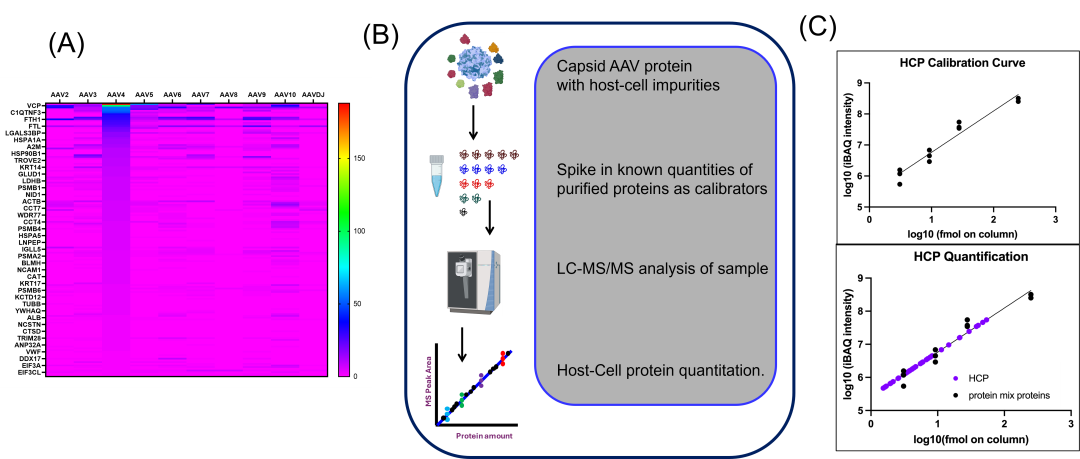
图5. (A)热图展示了在多个血清型中常见宿主细胞蛋白杂质的变化情况。(B)使用已知纯化蛋白建立校准曲线以量化HCP的工作流程。(C)使用一系列10-12种蛋白,在跨越三个数量级动态范围的情况下,对AAV中的HCP进行定量分析。
08HEK细胞中HCP杂质的天然丰度
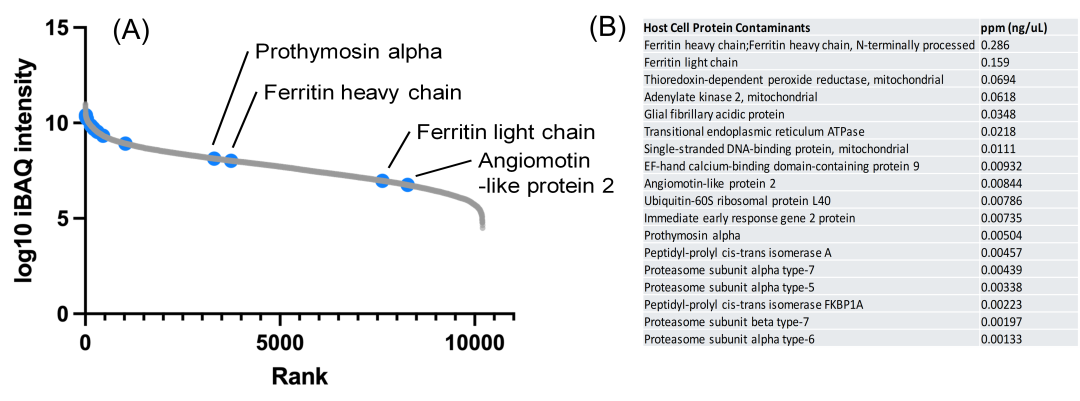
图6. (A)HEK细胞蛋白质组的iBAQ分析。蓝色的点表示观察到的蛋白杂质的自然水平。(B)根据图5所示的校准曲线,对AAV2中的HCP进行定量分析。正如观察到的那样,即使是低丰度的蛋白,如铁蛋白轻链和血管运动素样蛋白,也在AAV2中显著富集。
09总结
● 使用高度序列特异性的蛋白酶相比于非特异性蛋白酶是一个更优的选择,因为前者具有更一致的消化效果和更少的峰需要分析。
● 通过我们新颖的基于SP3的脱盐/蛋白酶解方法,几乎可以实现完全的序列覆盖。
● 蛋白酶解具有高度特异性,可以高置信度地轻松识别出正确的AAV血清型。
● 类似的方法也可以应用于宿主细胞蛋白(HCP)的定量。
● 使用添加了已知摩尔量的纯化蛋白混合物,有助于这些HCP的定量分析。
10资料下载