
Ficoll细胞分离液产品是经典的无菌即开即用型密度梯度介质,可以根据细胞密度的不同从样品中分离出目标细胞,具有高活性,高纯度,高回收率等特点。
.png)
Ficoll Premium系列三款产品
此外,Ficoll-Paque premium产品具有1.077,1.084和1.073三种密度,为客户提供更多的密度选择。具体密度适用范围参照下表:
产品选择指南
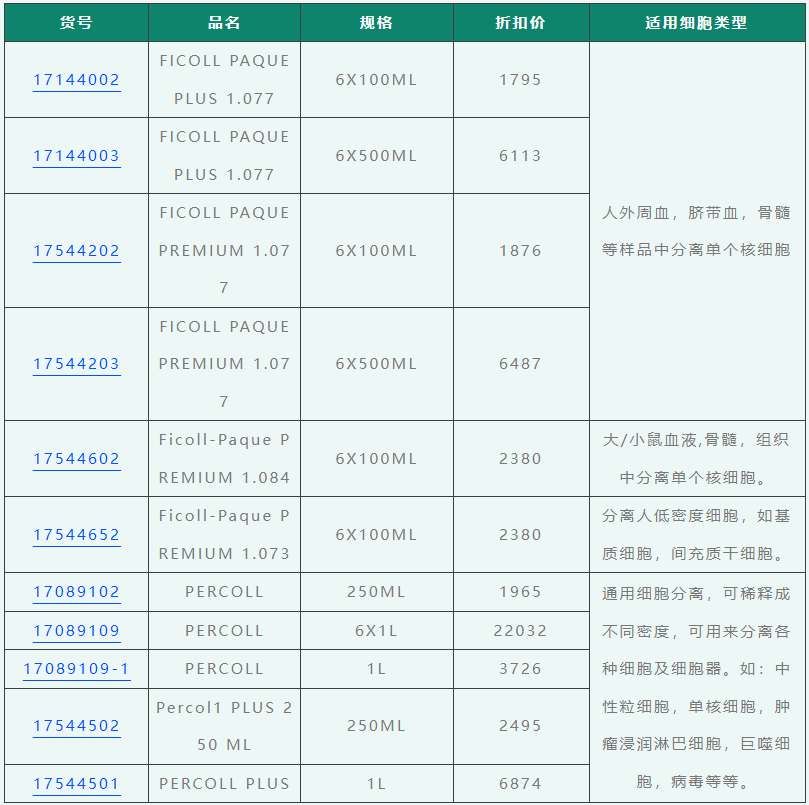
买细胞分离液找小优,即享68折扣,10箱以上即享66折扣!快来选购吧!
细胞分离液的应用和使用方法小优之前也做过很多介绍,可以点击查看:
Percoll 、Ficoll 深度详解,让你的细胞分离不再难
常规的应用大家可能也都比较熟悉了,今天我们来看下使用Ficoll-Paque Premium 1.073分离人间充质干细胞的方法。
人间充质干细胞治疗市场分析
根据Dimension Market Research【5】在2025年3月份发布的报告(Report Code : RC-1217),全球干细胞治疗市场规模预计将由2024年的189亿美元激增至2033年的547亿美元,即复合年均增长率CAGR为12.6%,如图1。
其中,占比重最大的为成体干细胞(蓝色部分),主要包括造血干细胞以及各种组织来源的间充质干细胞等,其易于获取、疗效佳、不易癌变,且无伦理风险。
.png)
图1:全球干细胞治疗市场预测(Dimension Market Research)
近期,间充质干细胞的上市申请也捷报连连。2024年12月18日,Mesoblast Limited公司的Ryoncil(remestemcel-L)成为全球首个被FDA批准的间充质干细胞疗法6,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD),作为全球首个“现货型”、同种异体、骨髓间充质基质细胞疗法,也为其它hMSCs细胞治疗产品树立了范例。
15天后,2025年 1月2日,国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准我国首款间充质干细胞治疗药品艾米迈托赛注射液(商品名:睿铂生)上市7,其用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD),作为处方药,是一款人脐带间充质干细胞注射剂,历经12年潜心研发,也是我国首款获批的干细胞药物。
前述两个里程碑式的细胞治疗药物,都利用了hMSCs所具有免疫调节和组织修复功能,用于治疗移植物抗宿主病。紧接着,2025年3月22日,根据第二届博鳌乐城干细胞大会报告,三项干细胞相关转化应用项目得到批准,其中两项为间充质干细胞相关,包括脐带间充质干细胞注射液治疗膝骨关节炎技术、改善射血分数减低型心力衰竭的脐带来源间充质干细胞治疗技术。
早在1974年,Friedenstein AJ等8通过塑料黏附特性,从骨髓中首次分离出人类间充质干细胞(Human Mesenchymal Stem Cells, hMSCs),后续科学家又从胎盘、脐带、脂肪组织、羊膜、宫血、牙髓等获得hMSCs,其主要优势:
hMSCs可在一定代次内进行自我复制并维持未分化状态,具有多分化潜能可用于组织修复9和再生医学。
hMSCs通过分泌细胞因子及胞外囊泡发挥抗炎10及免疫调节作用,并被招募到炎症或损伤部位11,可用于免疫性疾病治疗、移植物抗宿主病和促进组织重建(如神经系统)。
又因其免疫原性低,具有跨MHC屏障移植12的特性,单一供体可惠及众多患者。
此外,hMSCs还可以迁移到肿瘤微环境中,作为药物或基因治疗载体13、14、15,其外泌体16在药物递送方面同样备受瞩目。
人间充质干细胞hMSCs分离方法
间充质干细胞的分离方法也在不断“进化”:1974年Friedenstein AJ等8使用贴壁法分离骨髓间充质干细胞并沿用至今,后续又发展出密度梯度离心17、组织爬出法18、酶消化法19、红细胞裂解法20、免疫磁珠吸附21、流式细胞术22等,不同组织来源的hMSCs适用的分离方法稍有差异23,也可以组合使用。
其中,密度梯度离心法为常用技术之一17,又以Cytiva Ficoll-Paque分离试剂最为经典,通常用于骨髓、脐带、脐带血、胎盘、关节滑膜液等样品23。
FICOLL-PAQUE PREMIUM 1.073用于hMSCs分离
2008年,Cytiva上市了Ficoll-Paque PREMIUM 1.073 (g/mL),其密度低于常规的Ficoll-Paque PLUS(1.077 g/mL),主要设计用于间充质干细胞或者低密度单核细胞(monocytes)的分离。
Ficoll-Paque PREMIUM在严格控制的环境下生产,符合ISO 13485:2003,符合欧盟委员会GMP 指南无菌药品生产要求,依从美国药典章节<1043>的相关规定,因此推荐用作临床研究和细胞治疗24,提供RSF法规支持文件。
产品上市同年,2008年9月,Gary Brooke等25即发表文章,将Ficoll-Paque PREMIUM 1.073用于人胎盘间充质干细胞的分离,将胎盘先剪成小块,再使用酶法孵育(100 U/ml I型胶原酶 + 5 μg/ml DNase I),最终获得约30 ml HBSS重悬的单细胞悬液,并在下层铺设12 mL Ficoll-Paque密度梯度介质,540 g离心20 min(20℃,关闭刹车),取白膜层,用HBSS清洗两次,使用完全培养基重悬细胞并接种于8个T175培养瓶,经过连续4次传代到P5,每次接种于90个T175细胞培养瓶(剩余细胞全部冻存),如图2,并最终用于临床试验中。
.png)
图2:Ficoll-Paque PREMIUM 1.073用于胎盘来源人间充质干细胞的分离和传代扩增
紧接着,2010年,GIULIA GRISENDI等26系统地比较了Ficoll-Paque PREMIUM(1.077)及更低密度的Ficoll-Paque PREMIUM 1.073在骨髓间充质干细胞分离中的差异,以期建立符合GMP要求的标准化流程。
骨髓来源间充质干细胞(Bone marrow mesenchymal stem cells,BM-MSCs)由于广泛的分化潜能,研究最多,其在再生医学、肿瘤基因治疗、免疫性疾病中得到广泛关注和应用,但是骨髓中hMSCs占比很低(0.001 – 0.01%)26,因此需要分离和扩增后方可进行研究及临床应用。
文章使用13位肿瘤病人的样本,年龄6-62岁(Ave. 48岁),来自9位男性4位女性。每位患者取髂后嵴,0.5-1 mL柠檬酸钠冲出骨髓,使用无钙镁PBS对半稀释,吹散,分别取等份的2.3 mL样品,铺到Ficoll-Paque PREMIUM(1.077或1.073 g/mL)的表面,参考试剂说明书的标准程序进行分离,623 g离心20 min,取白膜层PBS清洗两次,这部分即为单个核细胞MNCs层,其中含BM-MSCs。
使用无血清培养基,以800 000 cells/cm2接种密度铺6孔板,每2-3天换液,去除悬浮细胞。待长到80-90%汇聚后,胰酶消化,并以5000 cells/cm2传代,至P4。所有实验设置2组重复。
使用Ficoll-Paque PREMIUM 1.077和1.073分离BM-MSCs,细胞收率无显著差异,活率高(≥95%),如图3所示。说明分离有效,且无细胞毒性。
_1.png)
图3:使用Ficoll-Paque PREMIUM1.077和1.073分离BM MS后,细胞收率(A)和7-AAD染色后的活力数据(B)
根据国际细胞治疗学会(ISCT)于2006年36提出的最低鉴定标准,hMSCs需至少具有三个方面特征:
1形态学(纺锤形贴壁)
2表面标记物(表达如CD90, CD73, CD105, CD146和GD2,且造血标记分子阴性)
3多分化潜能(体外特定条件下分化为间质细胞,即成骨、成软骨、成脂分化)
因此,文章中对BM-MSCs进行了流式细胞分选(FACS)分析、体外诱导三系分化,并检测CFU-F(成纤维细胞集落形成单位)的数量。
根据流式细胞术分析结果,相对于仅使用裂红试剂去除红细胞的对照样品(Lysis组),Ficoll-Paque PREMIUM 1.077和1.073均显著降低了白细胞共同抗原CD45+细胞(如淋巴细胞和粒细胞)的比例,CD14+单核细胞也有降低但差异不大,同时,CD105+ 目的细胞的比例有显著提高。
1.077和1.073二者相比,CD45+杂质细胞的去除效果,后者更佳且具有显著性差异,其它阳性CD分子的比例均有不同程度的提高但差异不显著,如图4。推测由于Ficoll-Paque PREMIUM 1.073(g/mL)的密度比1.077更低,使得比BM-MSCs密度更高的淋巴细胞、粒细胞沉于1.073 g/mL分离液之下,因此白膜层BM-MSCs纯度更高;如果使用1.077 g/mL分离液,则这些细胞均位于白膜层中。
使用Cytiva Percoll细胞分离介质自行配制低密度分离液,具有类似效果27。
_1.png)
图4:BM-MSCs免疫表型结果(流式细胞术)。Lysis为仅用红细胞裂解液处理(未进行密度分离),作为对照。样品为使用对应密度梯度介质分离后立即检测,未经过培养。
贴壁培养15天后,计数CFU-F克隆形成单位(>50个细胞)。使用两种分离液获得的细胞,形态正常,克隆大小相似,但相比于1.077,1.073分离的BM-MSCs具有显著更高的CFU-F数量(7.9±3.3 X 10^6 cells),达到1.5倍差异。1.073分离后,平均1.2 X 10^5 BM cells形成一个克隆,与健康人类似28。这点对于实验中使用的肿瘤病人样本,由于疾病和治疗造成微环境受损,MSC前体细胞数量本来就较少29,意义更加凸显。
此外,传代培养结果再次佐证了CFU-F检测到的增殖潜力差异,一开始两种密度梯度介质分离的BM-MSCs增殖能力相似,P1收获时,每1 mL骨髓样品大约获得10^5 BM-MSCs。但是到了P4,1.073获得的BM-MSCs数量(3.35±0.83 X 10^6)远高于1.077组(1.86±0.49 X 10^6),具有显著性差异。
1.073分离的BM-MSCs,从P1到P4细胞总数量增加35.2倍,临床上如果获得至少20 mL骨髓细胞悬液,将在P4收获到29.13 X 10^6个细胞[(3.35 X 10^6 cells/2.3 mL) X 20 mL]。
通过计算累积群体倍增(cumulative PD),即细胞在多次传代过程中的倍增次数,结果发现1.073在每个代次的数值均高于1.077,显示了更高的倍增潜力,这对于临床应用需要短时间获得大量细胞具有重要意义。另外,从细胞倍增时间(doubling time)来看,1.073分离的hMSCs在各个代次保持稳定,而1.077则倍增时间逐渐延长提示细胞老化(7-AAD也显示更多死细胞),如图5。
_1.png)
图5:累积群体倍增(A)以及倍增时间(B)。
对P4代次样品进行FACS分析,1.077和1.073分离培养后的样品,造血(分化)标记物分子表达均低,但是,1.073组有更多比例的细胞表达MSC Markers,如CD90、CD105、CD73和GD2,其中CD90+细胞在两组之间具有显著性差异。
从平均荧光强度(Mean fluorescence intensity,MFI)来看,即细胞表面的抗原表达量,1.073组呈现出更高的CD90(增殖潜力强30)、CD146和GD2(干性强31)表达,提示其最初分离的BM-MSCs亚群即具有更高水平的MSC Markers表达量。后续,也成功进行了三系分化。
综上,Ficoll-Paque PREMIUM 1.073可以有效分离BM-MSCs,相比于经典的1.077 g/mL密度介质,二者收率相当,但1.073 效果更佳,表现在:
1
收获细胞的增殖潜力更大,有利于满足临床应用需要短时间进行大量培养的需求;
2
因介质密度更低,更好地去除了其它单个核细胞的污染;
3
分离到更多具有更高分化潜能的细胞。
2012年,Naser Ahmadbeigi等32进一步研究发现,由于部分BM-MSCs会形成聚集体,采用Ficoll 1.073进行分离时,可以同时回收管底细胞并裂红,继续培养获得BM-MSCs聚集体克隆33。
2017年,Baghaei K等34开发出一种简单快速的从骨髓中分离、诱导分化和鉴定hMSCs的方法。通过回收Ficoll-Paque离心后的白膜层并进行贴壁培养,去除非贴壁细胞后,成功进行了三系分化以及FACS表型鉴定。
2025年3月,Ester Moñivas等35发表文章再次证明Ficoll-Paque介质分离BM-MSCs的有效性,并且在GMP环境下将手工分离和Cytiva自动化封闭系统Sepax细胞处理仪进行平行比较,证明二者均有效,后者收率稍高。

