骨衰老与中枢神经系统衰老及脑血管疾病有着独特的联系。骨质疏松症是一种常见的年龄相关性疾病,在神经退行性疾病患者中更为普遍。骨密度降低的发生在患有神经退行性疾病的患者中呈高风险,尤其是在痴呆患者显著升高[1]。相关研究表明,骨密度的降低与大脑白质疾病息息相关,其主要病理特征主要集中在大脑小血管和毛细血管的改变[2]。尽管目前已提出了骨-脑轴的相关概念,但人们对骨脑轴中涉及的细胞和分子基础,以及该轴如何参与脑血管系统的衰老过程知之甚少。因此,阐明骨衰老与中枢神经系统衰老发生的内在联系及相关机制,是预防神经退行性疾病和发展靶向防治药物研究中亟需解决的关键科学问题。该研究揭露了骨衰老过程中,衰老破骨细胞大量分泌PDGF-BB入血,并通过调控MMP-14剪切PDGFRβ导致血管周细胞丢失的分子机制,对深入认识骨衰老与中枢神经系统衰老发生的内在联系及相关机制及其个体化精准治疗提供理论依据。

为了明确衰老过程中PDGF-BB含量及大脑血管/周细胞的改变,ELISA结果显示血液中PDGF-BB的含量随年龄增加逐步升高,免疫荧光结果证实相比于3月龄年轻小鼠,22月龄老年小鼠大脑海马区血管数量显著减少,周细胞覆盖率显著降低。提示血液中PDGF-BB的含量与海马区周细胞的丢失息息相关。
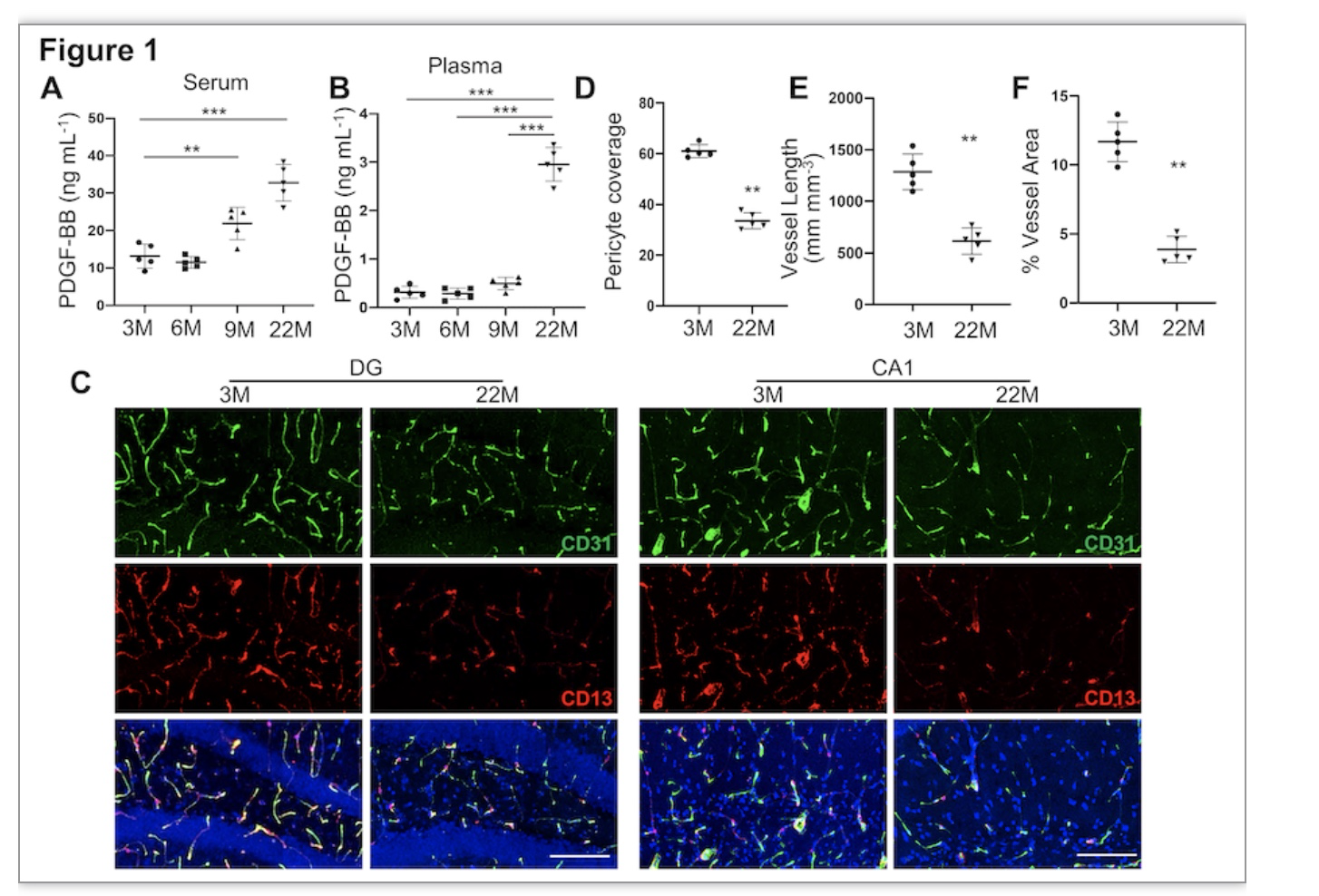
图1 衰老小鼠血中PDGF-BB含量及海马区血管/周细胞改变
作者团队前期研究指出,衰老过程中破骨细胞可分泌大量PDGF-BB。为了明确衰老破骨细胞分泌PDGF-BB对大脑海马区的影响,作者团队在Trap+破骨前体细胞过度分泌PDGF-BB的转基因小鼠(pdgfbcTG),结果显示,相比于相同年龄WT小鼠,pdgfbcTG转基因小鼠血液中PDGF-BB含量显著上升。并且,从6月龄开始,pdgfbcTG转基因小鼠海马区血管数量及面积的减少较WT小鼠明显减少,血管周细胞覆盖率显著降低。以上结果提示,破骨前体细胞分泌的PDGF-BB是导致海马区血管损伤的原因之一。
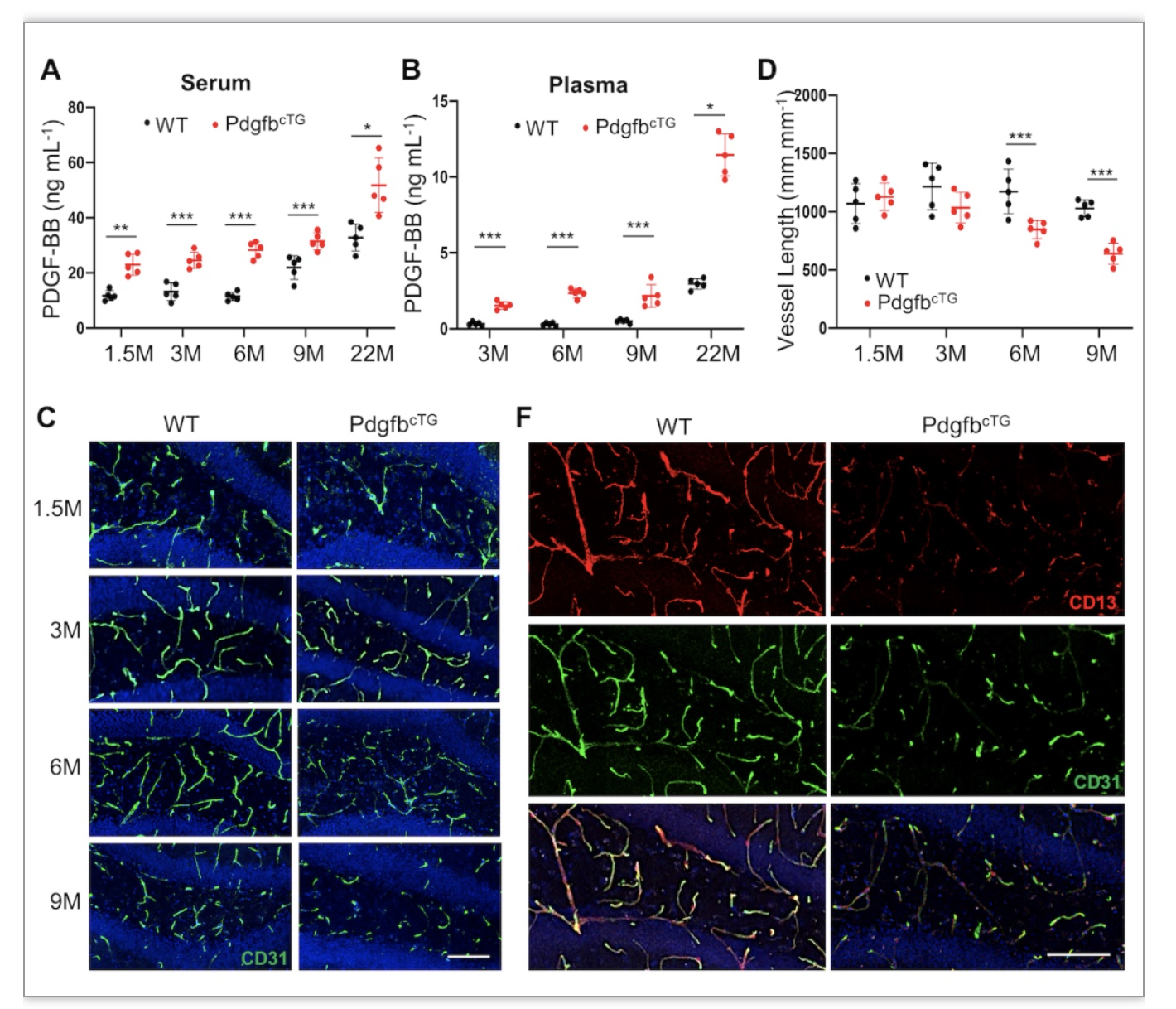
图2 pdgfbcTG转基因小鼠中PDGF-BB含量及海马区血管/周细胞改变
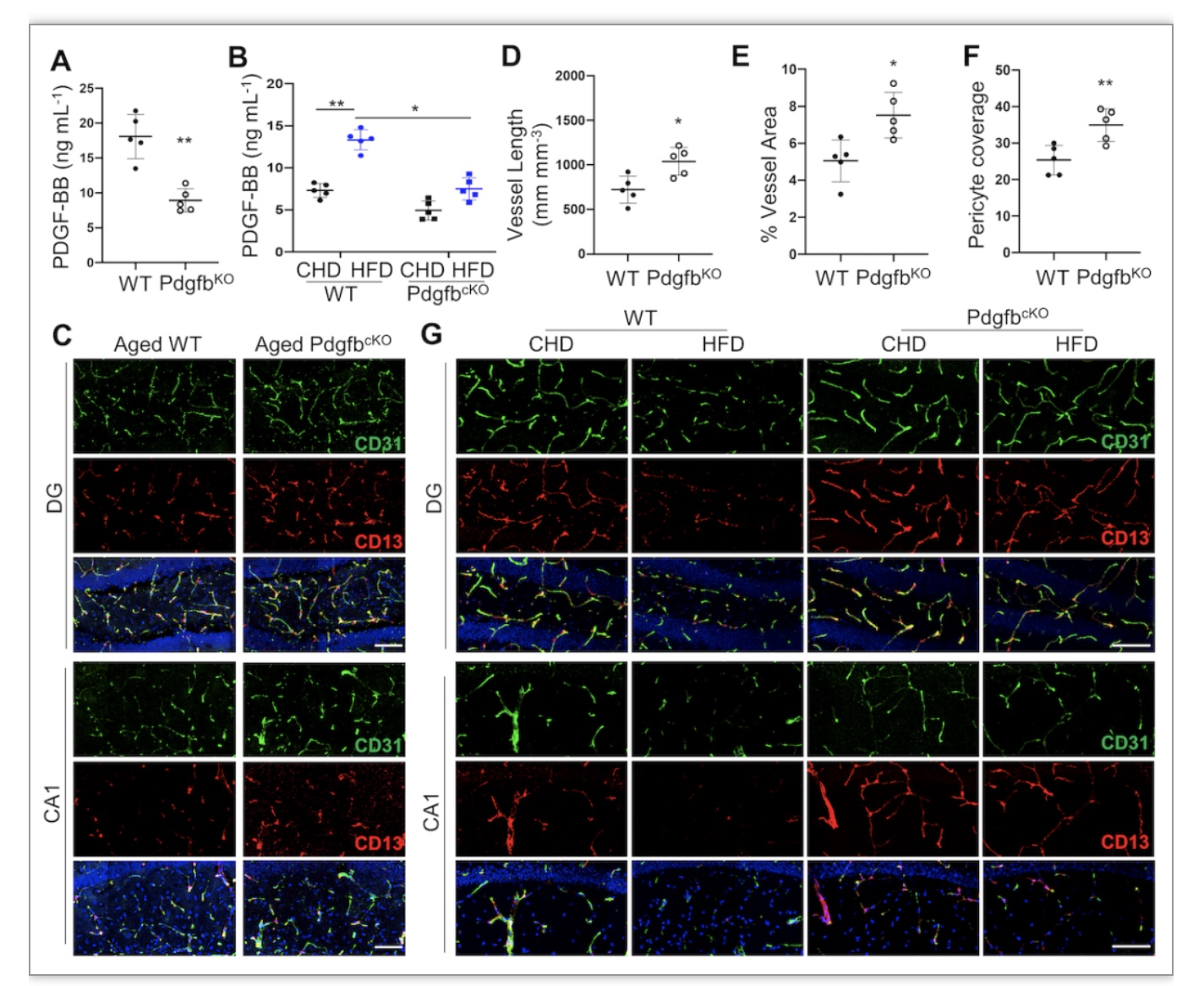
图3 PDGF-BB含量对海马微血管损伤和认知能力的影响
为探究PDGF-BB导致海马区血管损伤的机制,我们检测了PDGF-BB的受体PDGFRβ的表达,结果显示,6月龄血管周细胞上PDGFRβ表达明显降低。使用不同剂量PDGF-BB刺激血管周细胞不同时间点,PDGFRβ的含量均显著下降,且长时间不同浓度PDGF-BB刺激造成的PDGFRB进行性下调与受体内化无关。作为临床中周细胞损伤的标记物,可溶性PDGFRB(sPDGFRβ)的升高与痴呆及阿尔兹海默病息息相关(3-6)。作者团队发现,长时间不同浓度PDGF-BB刺激可进行性增加sPDGFRβ的生成。以上结果提示:长时间高浓度的PDGF-BB刺激是导致周细胞上PDGFRβ被切割形成sPDGFRβ的主要原因。
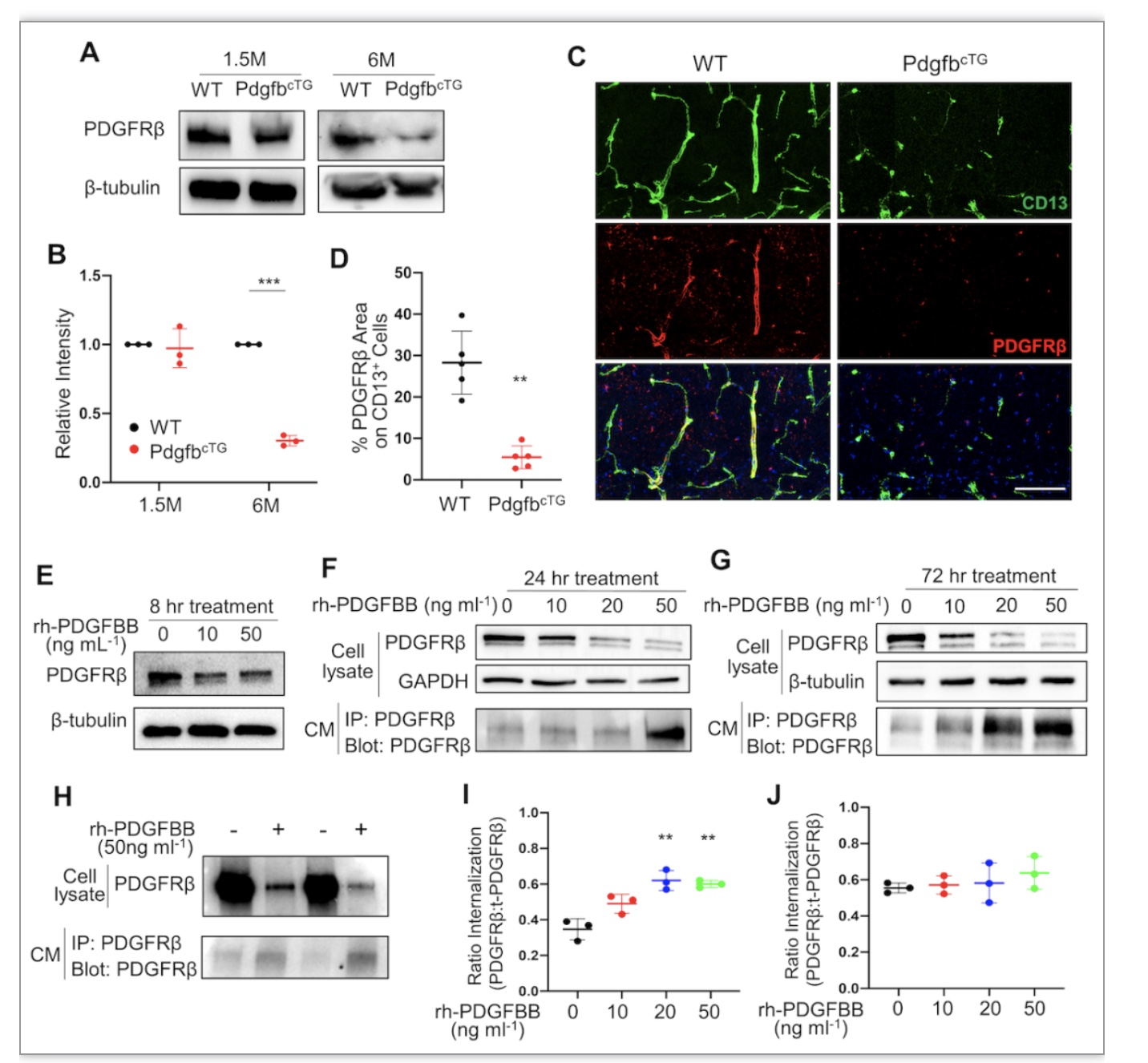
图4 高浓度的PDGF-BB刺激导致其受体在周细胞中脱落
最后,为了探究造成PDGFRβ切割的机制,PDGF-BB刺激周细胞后MMP14的表达显著上升,且发现明显的MMP14与PDGFRβ的共定位,提示二者存在相互作用。与此同时,在老年小鼠、pdgfbcTG转基因小鼠中MMP14显著上调,PDGFRβ含量显著下调。此外,抑制MMP14可显著提高PDGFRβ的表达,降低sPDGFRβ的含量。以上结果显示:MMP14的表达上调是PDGF-BB长期刺激导致PDGFRβ从周细胞上切割的主要原因之一。
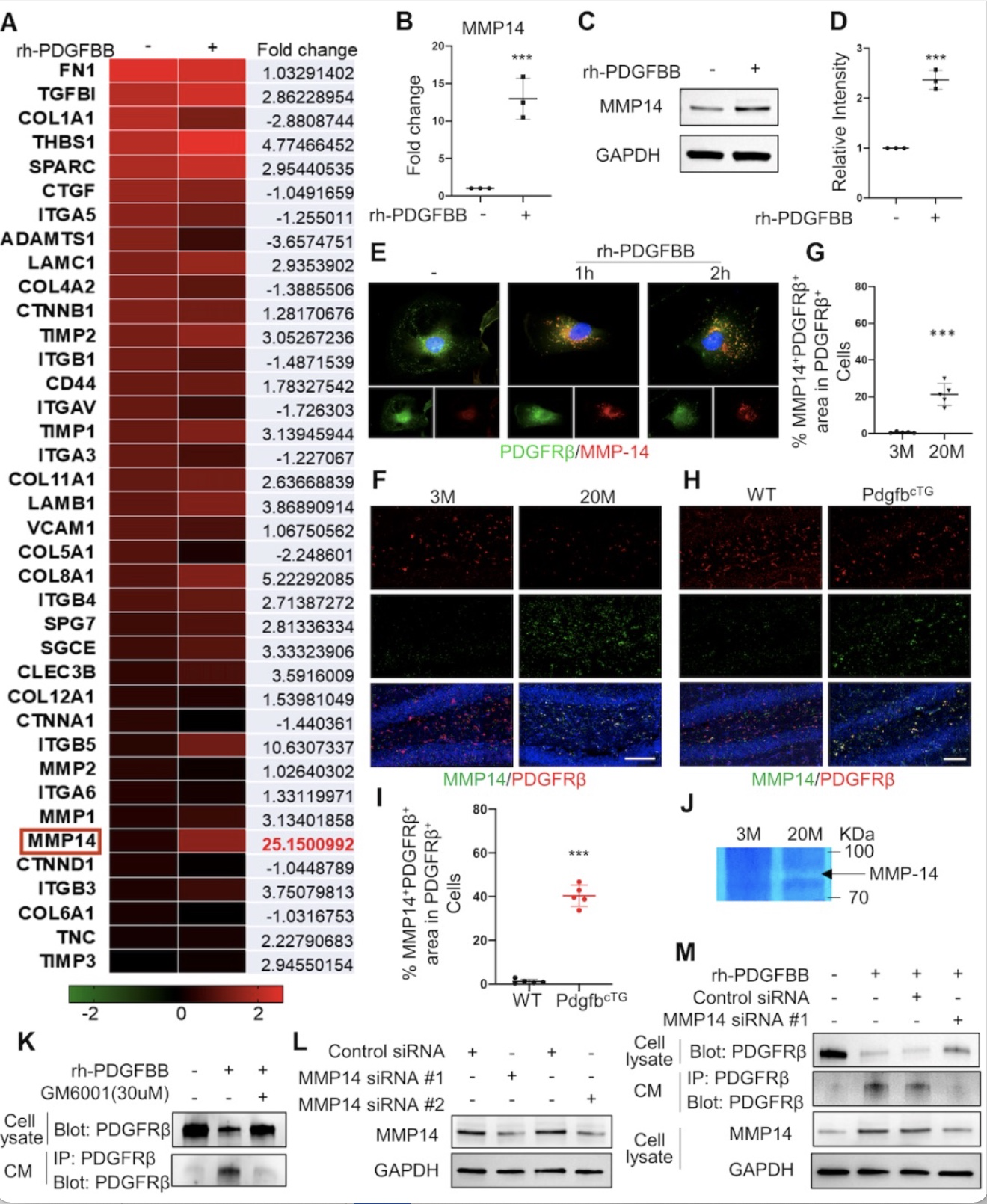
图5 MMP14介导PDGF-BB诱导的PDGFRβ切割
作者团队首次确立了PDGF-BB作为新的血源性促衰老因子的作用。PDGF-BB浓度一旦高于生理范围,就会加剧海马血管及血脑屏障的损伤。其次,作者团队揭示了一种调控脑血管中PDGF-BB/PDGFRβ信号通路的新机制。持续的PDGF-BB升高导致其自身受体PDGFRβ通过MMP14介导的切割作用导致其在周细胞中下调。该研究为目前对PDGF-BB/PDGFRβ信号通路在神经退行性疾病中的作用机制提供了新思路。然而,由于目前缺乏MMP14特异性的抑制剂,因此,使用MMP14的条件敲除小鼠或中和抗体进一步明确MMP14在调控PDGFRβ切割中的作用,需后续研究进一步证明。

