
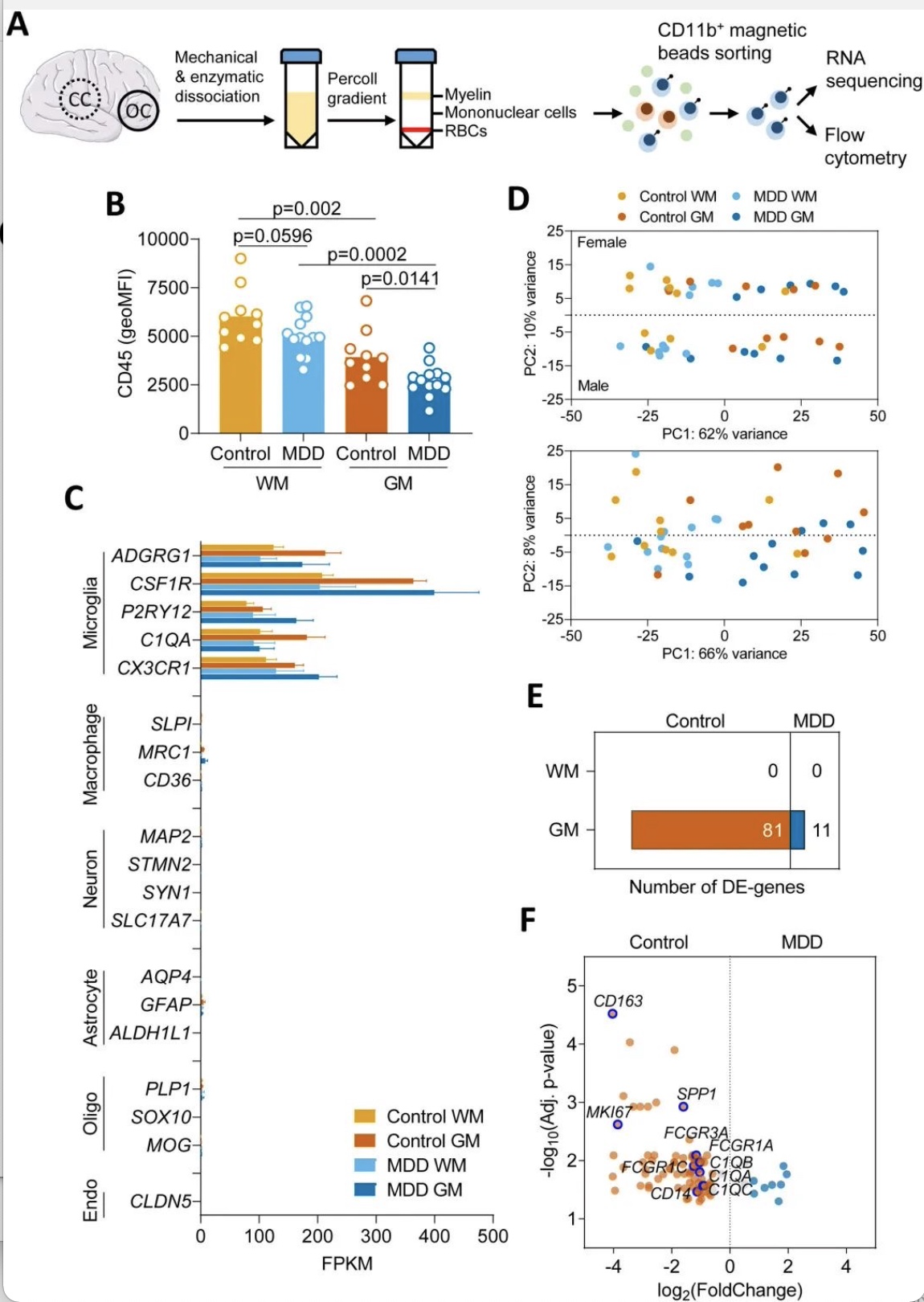
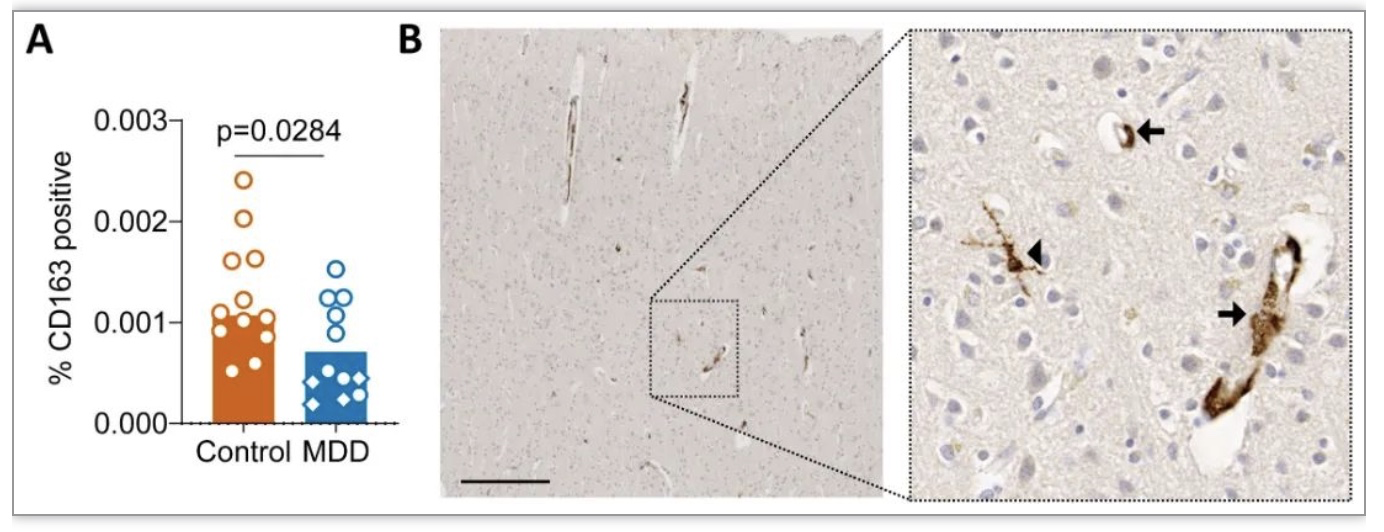
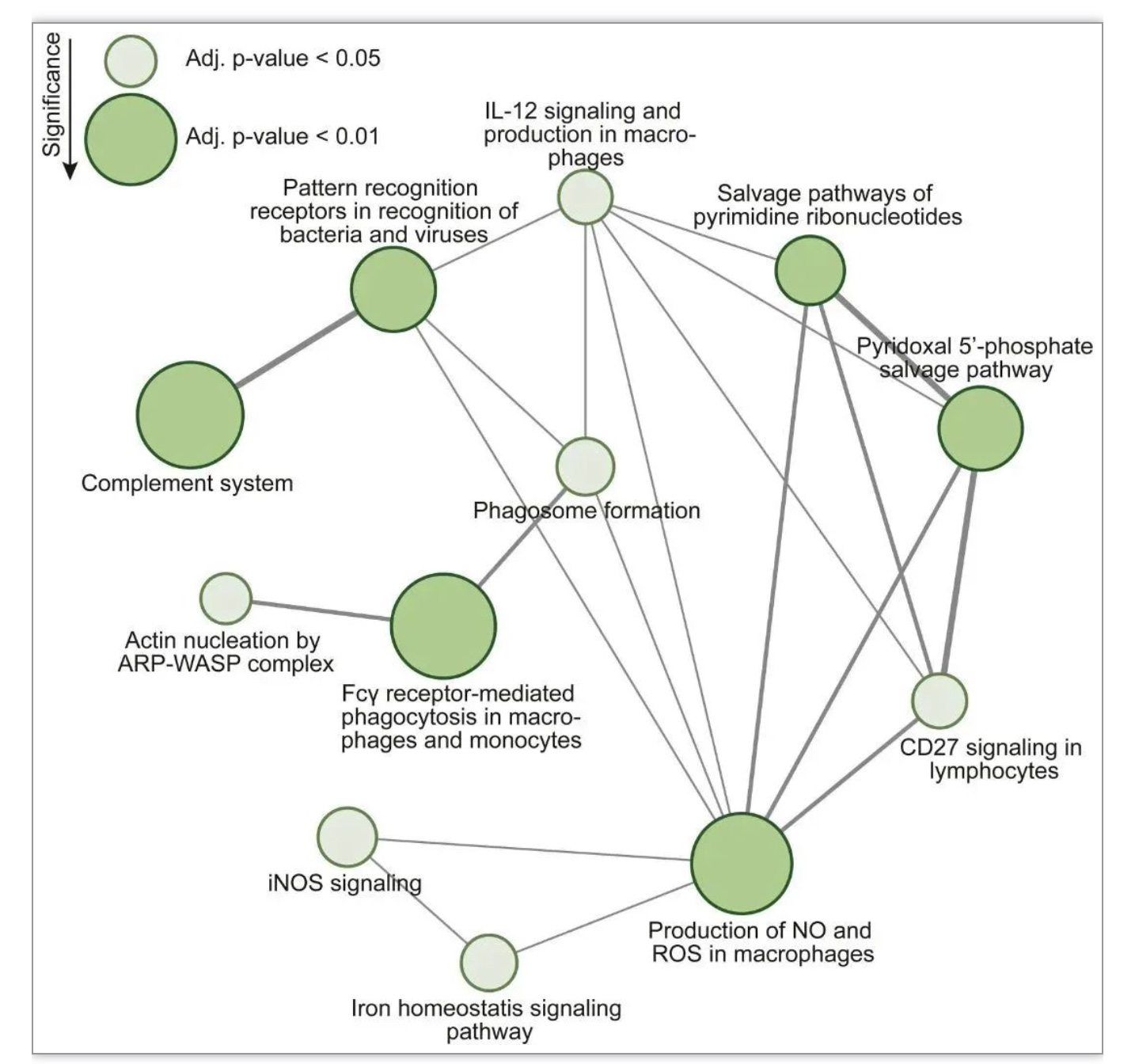
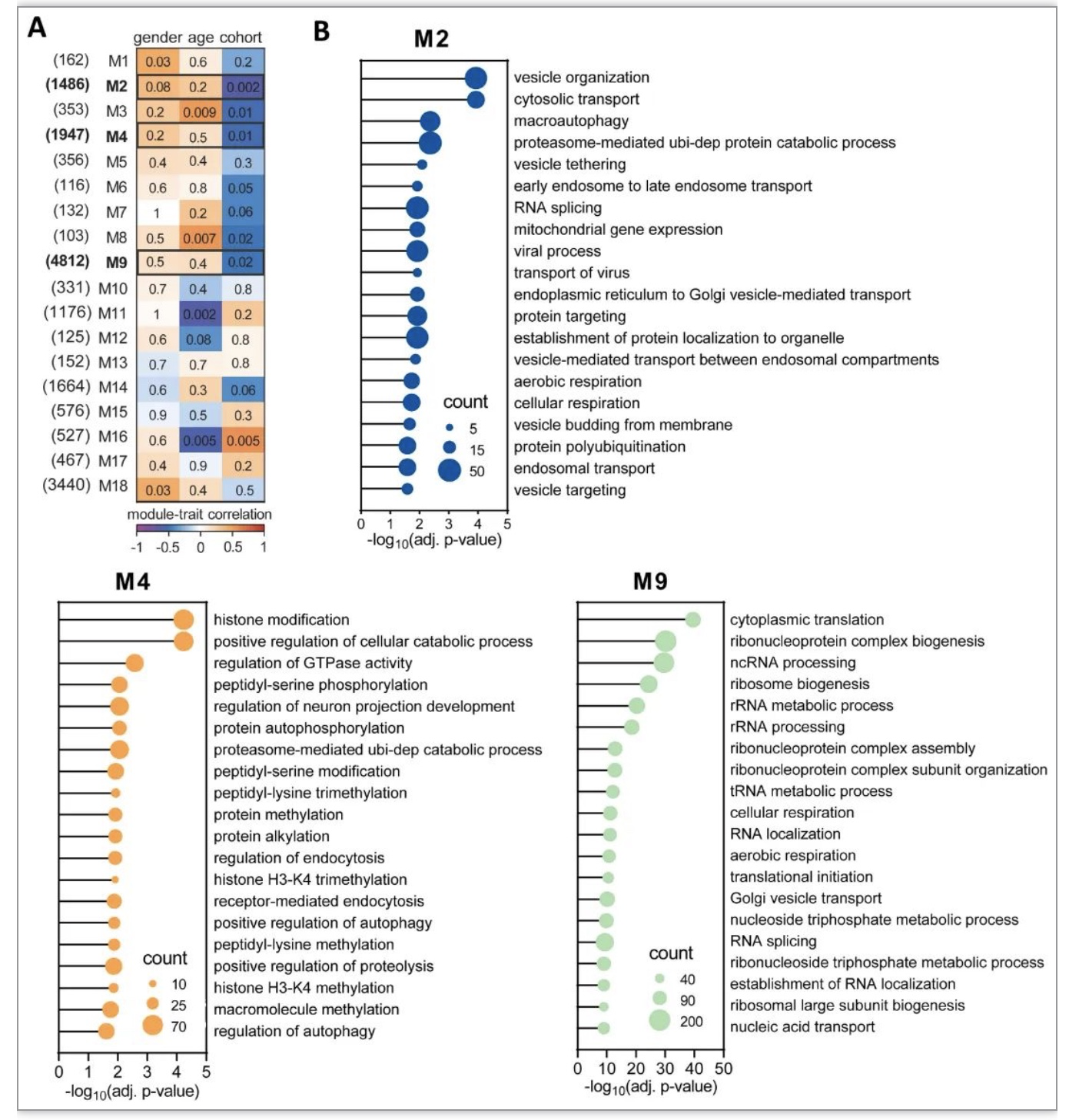
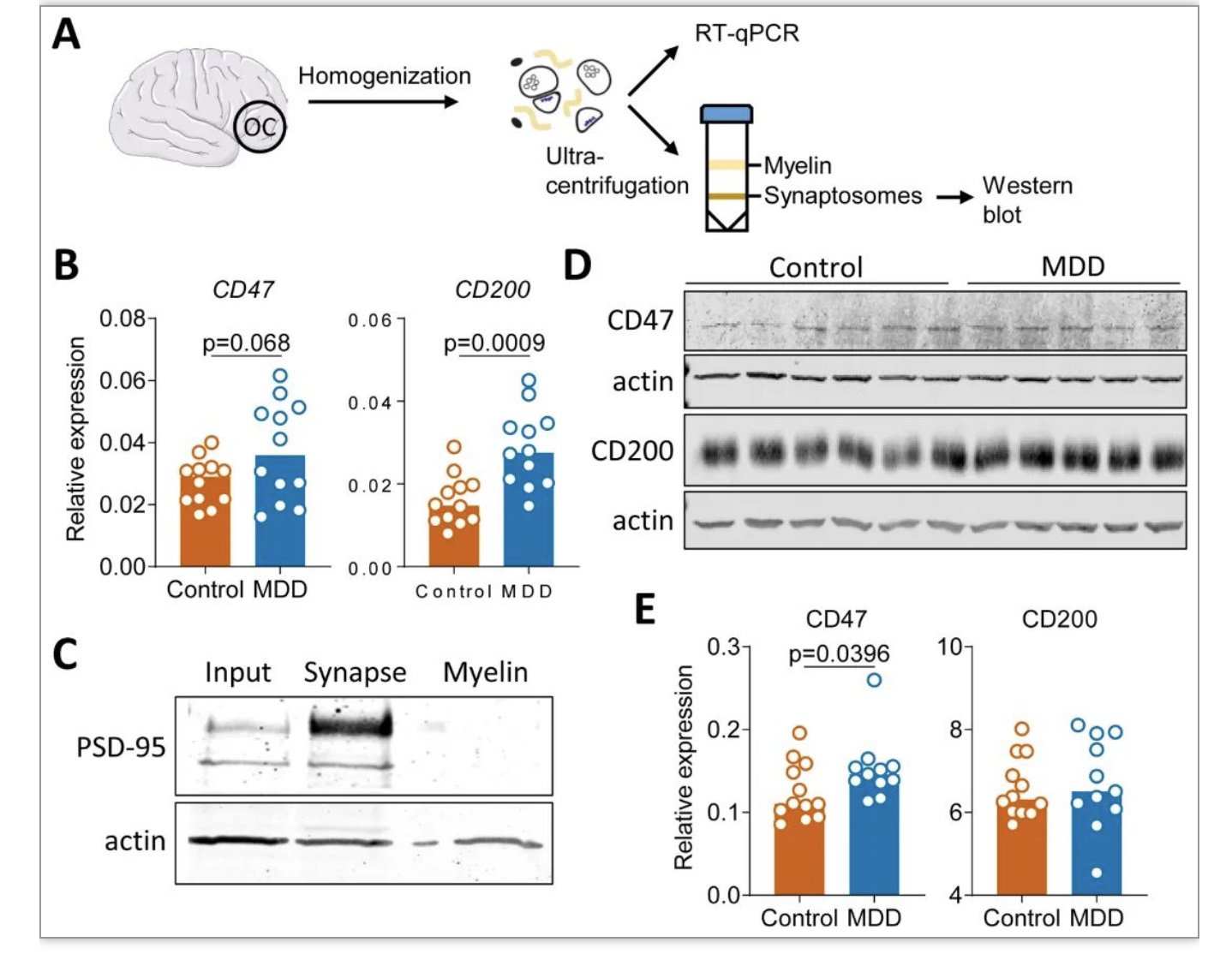
该研究发现来自临床诊断为MDD的供体的GM小胶质细胞, 显示出独特的疾病相关小胶质细胞(DAM)转录组谱,并将其命名为DepDAM。GM小胶质细胞的大部分DEGs下调,其中许多基因参与免疫应答和吞噬功能。通路分析显示免疫激活和吞噬活性发生改变。与对照供体相比,MDD GM小胶质细胞的CD45膜表达较低,在分离后立即进行评估,免疫抑制状态也很明显。但这项研究中几乎所有的重度抑郁症脑供体都接受了抗抑郁药物治疗,不能排除药物可能影响了小胶质细胞的炎症状态[8]。此外,一些捐助者无法获得关于死亡时抑郁症临床状况的资料。总的来说,这项研究在MDD的枕皮质中发现了免疫抑制的GM小胶质细胞表型,这可能是由神经元调节引起的。吞噬和补体激活减少的“冷漠”小胶质细胞状态可能对与MDD相关的突触代谢和连通性产生重要影响。DepDAM表型进一步增加了人类大脑中确定的小胶质细胞状态的连续性[9]。

