心血管疾病(Cardiovascular diseases,CVD)是全球非传染性疾病死亡的主要原因[1,2]。多样的危险因素、复杂的病理机制以及并发症使得心血管疾病的治疗更具挑战性,迫切需要有效的治疗策略。
作为真核细胞中最复杂和最关键的细胞器之一,线粒体在细胞信号转导、氧化还原平衡、氨基酸及脂质的生物转化、钙稳态、细胞凋亡、程序性细胞死亡等生物过程中起着重要作用[3,4]。心肌细胞是线粒体含量最高的细胞类型之一,高度依赖线粒体氧化磷酸化产生ATP。线粒体迅速适应不断变化的环境,以维持代谢稳态[5,6]。如何在临床治疗中有效地防治线粒体功能障碍,是心血管疾病治疗领域面临的一项极具挑战性的难题。
线粒体移植是将外源性功能完整的线粒体通过各种途径输注到病变部位,旨在增加线粒体数量和改善线粒体功能的新型替代疗法,对于心血管疾病的治疗具有巨大潜力[7]。由于线粒体中的蛋白质成分在多个生物途径中充当网络枢纽且在病理条件下经常同时受到影响。因此,与针对单个靶点的传统药物治疗相比,线粒体移植具有独特的优势[4]。细胞内线粒体运动促进动态线粒体网络的连接和形成。此外,在生理和病理生理条件下,在体外和体内均发现线粒体在细胞间的转移[3]。随着线粒体的动力学和其可转移能力逐渐被发掘,线粒体移植对CVD的治疗潜力作为一个快速发展的领域引起了人们的高度关注,对CVD的预防和治疗具有深远的意义。
该综述介绍了线粒体在心血管疾病中的重要作用,分析了线粒体异常引起的各种心血管疾病,总结了线粒体移植在心血管疾病中的多种治疗实践和策略。该综述概括了线粒体移植在心血管疾病中的研究基础和进展,并探讨了其在心血管疾病治疗中的机遇和挑战,为线粒体移植在心血管疾病中的靶向应用提供新的思路。
线粒体代谢的主要过程是糖、脂质和蛋白质通过三羧酸循环和氧化磷酸化,这涉及一系列酶促反应,为心肌细胞提供能量[8]。在生理条件下,与糖酵解相比,氧化磷酸化是产生三磷酸腺苷(ATP)更有效的方法。应激导致细胞内钙失稳态,可降低氧化磷酸化效率和ATP含量并产生过量的ROS。线粒体功能障碍可导致线粒体结构和膜电位异常、能量应激、氧化应激损伤,进而引发细胞自噬功能障碍和程序性死亡。上述病理生理学改变都与CVD的发生发展密切相关[9]。
线粒体转移可以发生于细胞间,但外源性线粒体如何内化并整合到受体细胞的线粒体网络中是线粒体移植研究中的一个关键问题。Masuzawa等人检测到线粒体不与任何溶酶体或自噬体共定位,表明外源性线粒体的内化[10]。进而发现,线粒体内化在心肌细胞中由肌动蛋白驱动[11]。许多证据表明,线粒体的动态转移不受细胞边界的限制,且细胞之间线粒体的转移可以整合到受体细胞的内源性线粒体网络中并发挥其生物学功能[12,13]。
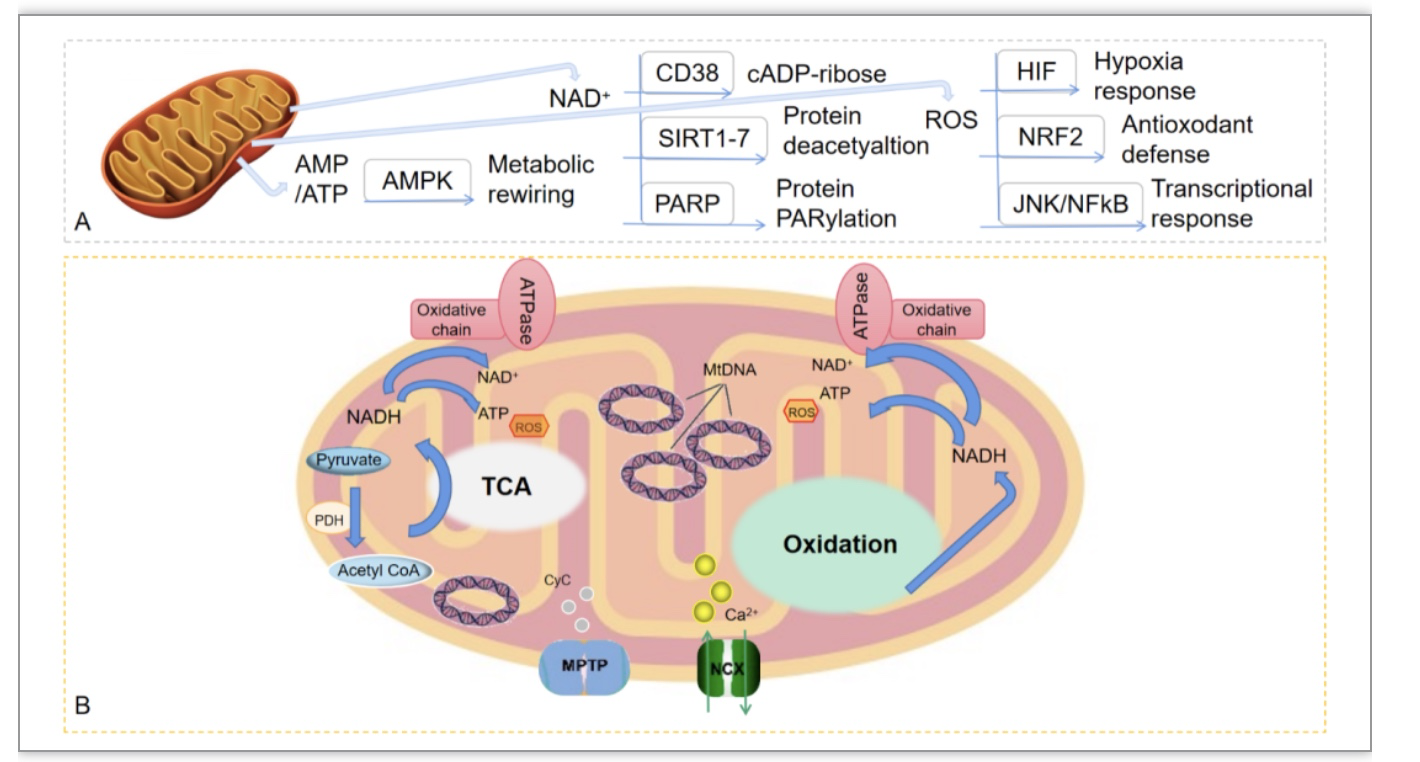
A.主要的线粒体代谢物和细胞信号通路。B.在心血管系统生理条件下参与线粒体代谢的主要因素和途径。
通过线粒体移植治疗CVD的方法包括裸线粒体移植、细胞介导的线粒体移植,而后者主要经隧道纳米管(TNT)、细胞融合和细胞外载体(EV)介导[3]。此外,间隙连接通道相关突触复合物和树突网络也能介导线粒体移植,但在心血管系统中尚未见报道[14,15]。
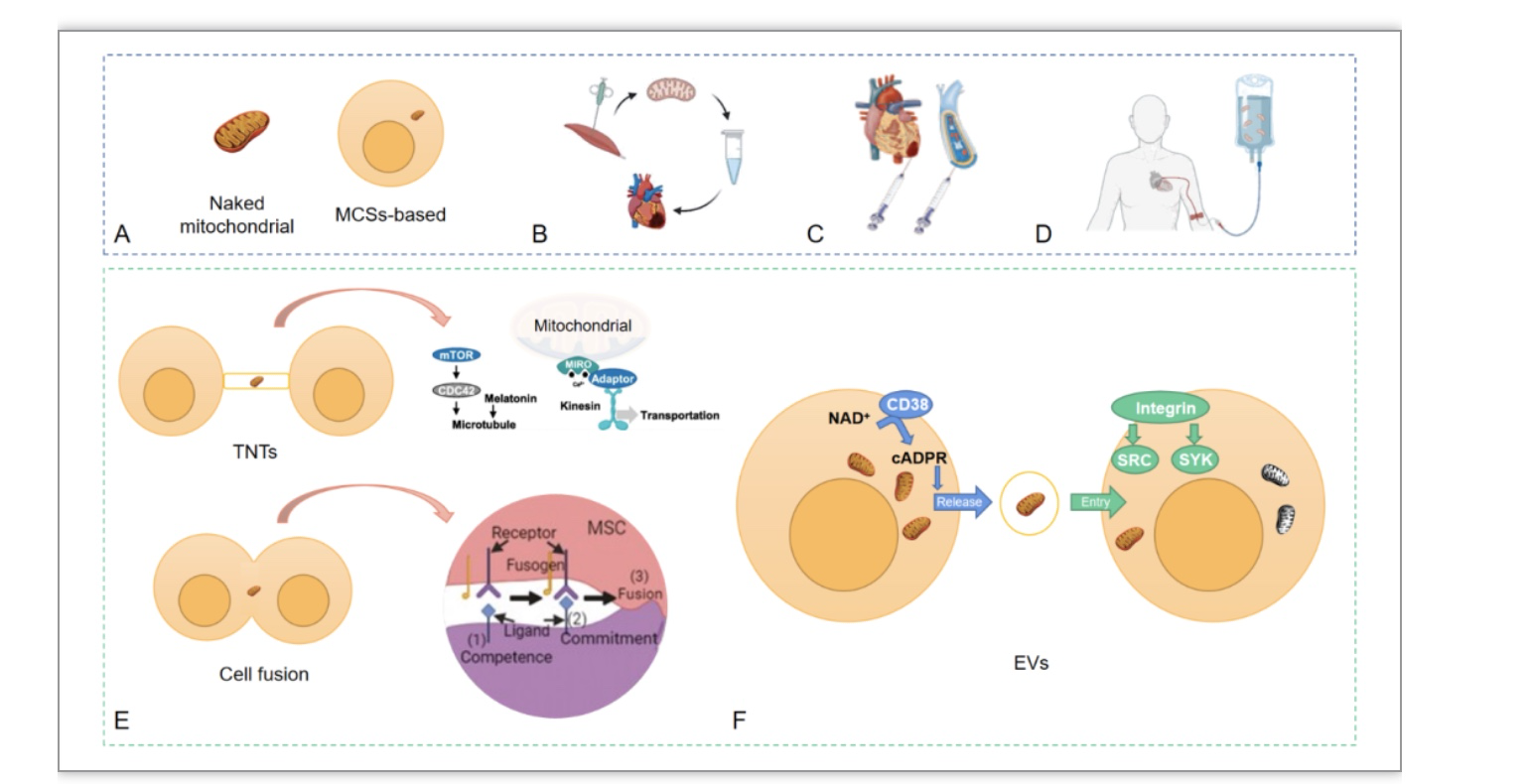
图2心血管疾病中线粒体转移的策略和机制。
A.裸线粒体或携带MSCs的线粒体。B.线粒体移植概述。C-D.不同的输送方法:线粒体可以通过直接注射到相关组织或通过静脉注射进行移植。E.基于细胞的线粒体移植。F.EVs。
裸线粒体移植是借助显微注射技术将从健康组织或细胞中分离的线粒体直接注射到心肌或冠状动脉或静脉中以改善心脏功能的技术[16-18]。有趣的是,无细胞线粒体在人体血液中没有氧化磷酸化的潜力,也不太可能在体内起作用[19]。该方法无自身免疫反应、微血管闭塞、心律失常和心肌内血肿等并发症风险,但技术要求高,疗效低[4]。
基于细胞的线粒体移植直接将间充质干细胞或祖细胞注射到心肌中。间充质干细胞可以来自具有高质量线粒体的多个组织[7]。隧道纳米管(Tunnelling nanotubes,TNTs)是一种由细胞膜、F-肌动蛋白、肌球蛋白和微管蛋白组成的连接细胞的瞬时丝状膜,研究表明它是新生大鼠心肌细胞和内皮祖细胞之间的一种新型细胞间通讯[20]。间充质干细胞(MSCs)通过隧道结构介导的线粒体转移在体外缺血再灌注(I/R)模型中修复受损内皮细胞[21]。在I/R损伤和蒽环类药物诱发的心肌病中,将MSCs介导的线粒体移植到内皮细胞可增强有氧呼吸,保护心肌细胞免受氧化应激的损伤,抑制左心室扩张和心肌纤维化[21-23]。
部分(暂时)或完全(永久)细胞融合是通过合并质膜来实现细胞器和细胞质成分逐渐共享的过程[24]。Acquistapace等研究了人骨髓间充质干细胞和人多能脂肪干细胞与部分成熟的小鼠心肌细胞的融合[25]。心肌细胞和人多能脂肪干细胞的共培养允许线粒体的交换,并促进心肌细胞重编程。间充质干细胞还通过旁分泌机制修复了受损细胞,然而,此方法存在许多的安全问题如心律失常和微循环阻塞,这限制了其应用[4]。
胞外通道(Extracellular vehicles,EV),包括外分泌体、微囊泡和凋亡小体,是细胞分泌并稳定存在于细胞外液中的纳米级双层囊泡,是细胞通讯、迁移和血管生成的重要信使[26]。最重要的是,EV介导的线粒体转移是发生在多个组织中的基本细胞生物学过程的一部分,这使得使用EV进行线粒体转移成为一个新的热点。Ibáñez等人[27]提出了一种新的线粒体移植策略,即人类诱导的多能干细胞来源的心肌细胞线粒通过EV分泌到受损的心肌细胞中,从而改善心肌梗死和I/R损伤。冠状动脉或静脉内注射线粒体可改善I/R损伤患者的心脏收缩力并预防左心室重塑[28]。Brestoff等人从脂肪细胞中分离的线粒体通过小型EV将其转移到心肌细胞中以改善I/R损伤[29]。不同EV的复杂组分使它们在各种疾病中独树一帜,该方法能够维持很高的线粒体稳定性,且没有微血管闭塞和心律失常的风险[4]。
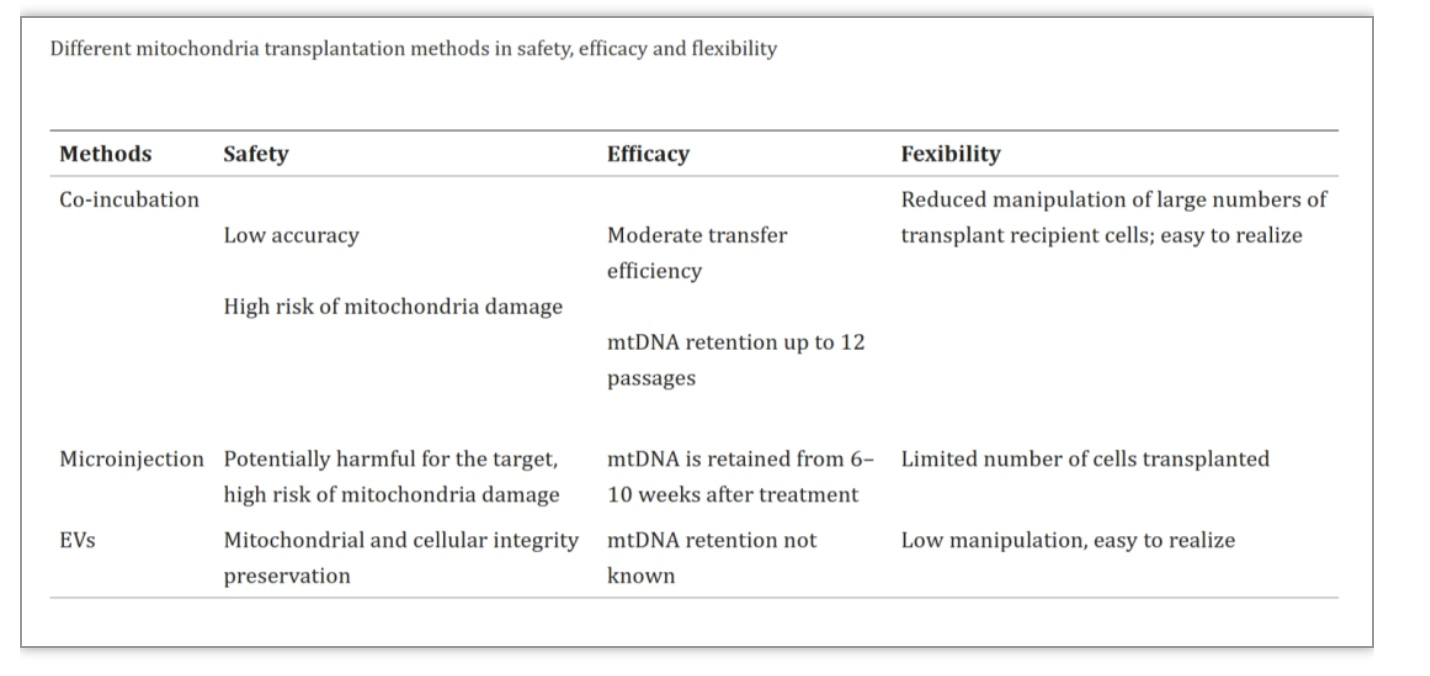
上述表格比较了线粒体移植通过共孵育、显微注射、EVs线粒体递送三种方法的安全性、有效性和灵活性。
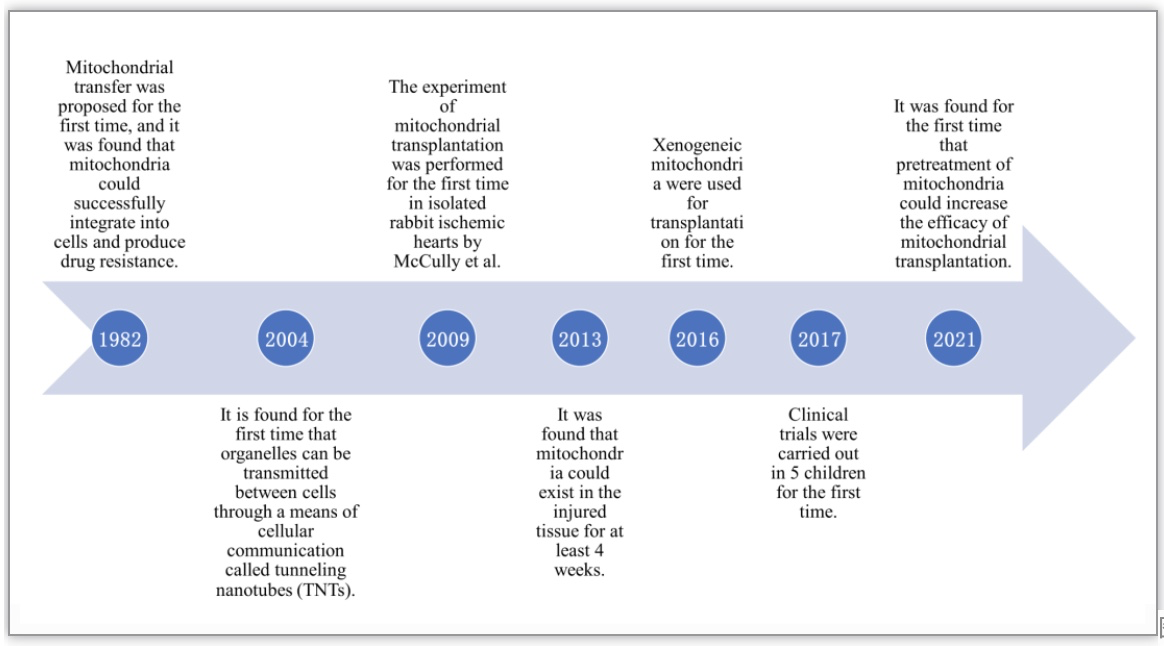
图3.线粒体移植研究的里程碑事件
靶向线粒体功能障碍的重要分子可显著改善心脏功能,因此线粒体替代疗法是保护心脏的重要方法[30]。关于线粒体移植研究的里程碑事件(图3)及很多相关研究表明,靶向线粒体移植是一种有前途的CVD治疗策略。许多临床前试验已经证明,线粒体移植在改善心肌I/R损伤、心肌病、心肌梗塞、心力衰竭、肺动脉高压、缺血性中风等CVD治疗中改善线粒体功能和心脏功能的独特优势。鉴于大多数研究中使用的线粒体来源自体线粒体,且线粒体单倍型可能对基因组表达产生很大影响,与线粒体核不相容性和有害突变的传播有关,技术挑战和伦理问题极大地限制了线粒体移植的临床应用[4, 44]。已发表的研究成果显示,线粒体移植在临床治疗中只应用于缺血性相关心脏损伤。首次关于线粒体移植的临床研究中,分离自非缺血性骨骼肌的自体线粒体并对体外膜肺氧合(ECMO)支持的I/R损伤儿童患者进行心包注射后,改善了心室功能,且没有引起炎症或排斥反应,然而由于样本量有限,尚不能得出具有统计学意义的结论[31].此外,线粒体移植显著减少了心肌劳损和不良心血管事件的发生。这表明线粒体移植有望治疗I/R损伤儿童心源性休克[17]。2021年McCully团队再次使用自体线粒体移植治疗儿童难治性心源性休克[2]。ECMO心源性休克患者自体线粒体移植有利于恢复心脏功能,进一步反映了线粒体移植在临床治疗中的巨大潜力。尽管线粒体移植的研究还处于起步阶段,许多问题仍未得到解答,但毫无疑问,这项新技术将具有广阔的前景。
与传统线粒体靶向药物递送疗法相比,线粒体移植的优势在于:(1)对多个靶点治疗效果更好,(2)相当于基因水平的病因治疗,(3)单次注射获益更多,(4)基于细胞的治疗转向无细胞治疗将大大提高线粒体移植的便利性。
近年来,随着线粒体移植的日益普及,关于这种治疗方法的争议也出现了,主要包括以下几个方面:
首先,怀疑论者指出McCully的团队并没有排除线粒体在注射条件下可能被破坏的可能性[33]。细胞外液中钙离子的浓度远高于细胞内液中的钙离子浓度,而线粒体对钙离子具有很强的渗透性,高钙条件下线粒体通透性转换孔mPTP的打开会导致线粒体内膜屏障破坏、线粒体通透性水肿、内膜破裂,甚至细胞死亡。虽然一些早期的研究发现线粒体在高钙环境中受损,但并不意味着它们完全无法存活。McCully团队还在血液中发现了游离线粒体,但其活性是否正常尚无法确定。[34]。
此外,McCully的研究小组发现,再灌注期间的线粒体移植可以在短短几分钟内改善心脏功能[10],而线粒体需要通过内皮屏障才能整合到心肌细胞附近,这个过程往往需要数小时。且没有细胞质环境,葡萄糖和脂肪酸转化为丙酮酸和脂肪酰基辅酶并不能揭示线粒体如何产生ATP[33]。
此外,尽管McCully及其同事发现与细胞共培养可以实现线粒体转移,但它们进入心肌细胞但数量很少[17],因此提供ATP的能力可能有限。研究表明直接给予外源性ATP并不能显著缓解心肌损伤[16],为了保证线粒体移植的效果,必须有足够的线粒体进入细胞产生ATP。事实上,线粒体的免疫原性也与移植效率密切相关。如何确保外源性线粒体不被个体排斥或被免疫反应吞噬,也是非常重要的问题之一。
线粒体可以在细胞之间转移已成为共识。在体外实验中,分离的线粒体与细胞的间接或直接共孵育会出现显著的细胞内吞作用,但线粒体与组织细胞接触后的内化机制尚不完全清楚。更重要的是,没有明确的研究证据和结论来说明以不同方式转移是否存在效率和功效差异。
当然,线粒体移植治疗的时间和条件可以进一步探索。从技术上讲,线粒体转移的第一步是分离线粒体,并确保线粒体的良好储存。同时,线粒体移植的核心问题是如何靶向线粒体并将其输送到特定的组织或器官。因此,未来的研究应侧重于开发用于特定细胞递送的载体,以提高线粒体内化的效率。
最后,线粒体移植的效果需要进一步验证和评估。递送方法应根据细胞或组织类型进行优化,并投入临床实践。