骨肉瘤是一种好发于儿童和青少年人群的恶性骨肿瘤,5年生存率在25% - 30%之间[1]。手术和化疗是目前治疗骨肉瘤的主要手段,但化疗所带来的生存获益,近40余年来未再获得进一步的突破,因此,迫切需要开发新的骨肉瘤治疗策略[2]。光热疗法(photothermal therapy,PTT)是利用光热剂(photothermal agent,PTA),在近红外光(near-infrared,NIR)照射下,将光能转变为热能杀伤肿瘤细胞的一种无创性肿瘤治疗新方法,具有不良反应小、特异性高等优点[3],然而,PTT对正常组织的热损伤一直是难以解决的问题,如何平衡杀伤效率和正常组织保护能力一直困扰着研究人员。除此之外,由于光的穿透深度有限,PTA在瘤内的积累和分布不足,使得PTT对深部实体瘤的治疗效果受到影响。目前,关于光热转换剂的研究众多,各种新型材料频出,影响PTA发挥作用的因素包括光吸收波长、尺寸大小及表面修饰等。尽管不同类型的PTA展现出了独特的优势,但一种集光热转换效率高、吸收波长长、生物安全性强、水溶性良好等众多优势为一体的光热材料有待被挖掘。

本研究通过受体工程,制备了一种供体-受体-受体(D–A–A')结构的NIR-II aza-BODIPY基光热剂 (SW8),用于1064 nm激光介导的骨肉瘤光热治疗(图1)。将供体基团变为受体基团,aza-BODIPYs的吸收最大值从NIR-I区(~808 nm)红移到了到NIR-II区(~1064 nm)。此外,SW8可以自组装成具有NIR-II强吸收和超高光热转化效率PCE(75%,1064 nm)的纳米颗粒(SW8@NPs)。这种超高PCE主要源自超快的分子间非辐射跃迁,是传统的分子内非辐射跃迁速率的大约100倍。最后,细胞和动物应用结果表明,在1064 nm激光介导下SW8@NPs可通过诱导细胞凋亡和焦亡的协同途径实现骨肉瘤的光热治疗,达到消融深部肿瘤且副作用小的目的。该研究不仅阐明了一种时空精准调控治疗深部肿瘤的方法,也为构建高性能小分子NIR-II光热剂提供了新的策略。
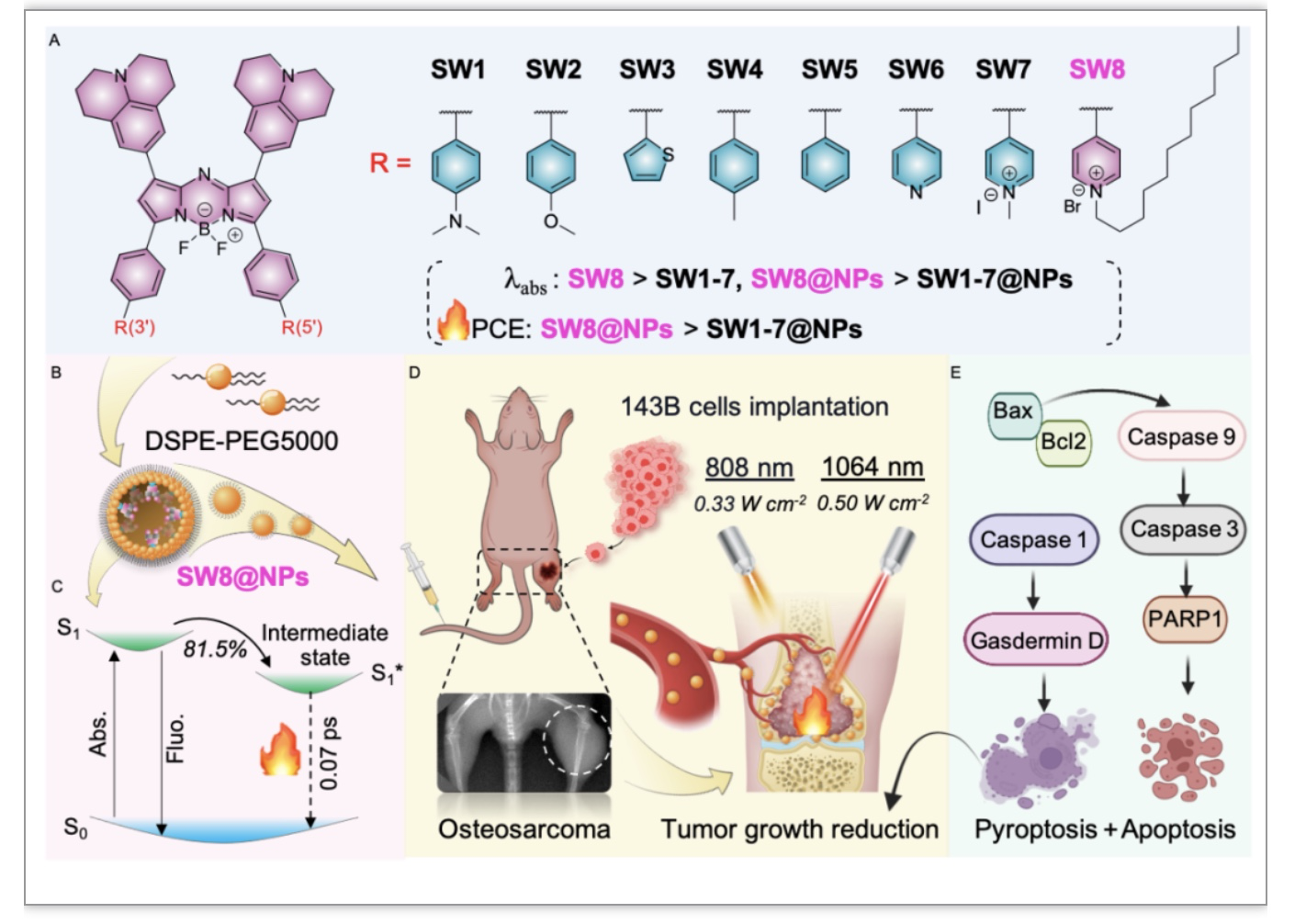
图1. 新型aza- BODIPY基NIR-II PTAs的理性设计及对骨肿瘤的光热治疗
本研究以aza-BODIPY为母体,设计合成了SW1-8系列有机小分子。光谱测试结果(图2b)显示从SW5到SW6的吸收光谱(黑色)和发射光谱(红色)发生了明显的红移,其中给电子的苯供体(D')变成了吡啶受体(A')。A′缺电子性增加导致SW6-8的吸收波长进一步红移,而供电子部分(SW1-5)未发生明显地波长红移。此外,烷基链的引入也增强了分子的J-聚集,导致SW6-8发射波长的红移。含时密度泛函理论(TD-DFT)计算显示,SW5到SW8的HOMO-LUMO能隙逐渐减小(图2c),变化趋势与吸收光谱一致。这些结果表明,aza-BODIPY的3位和5位受体基团显著减小了分子的能隙,为构建新型有机小分子NIR-II材料提供了新思路。
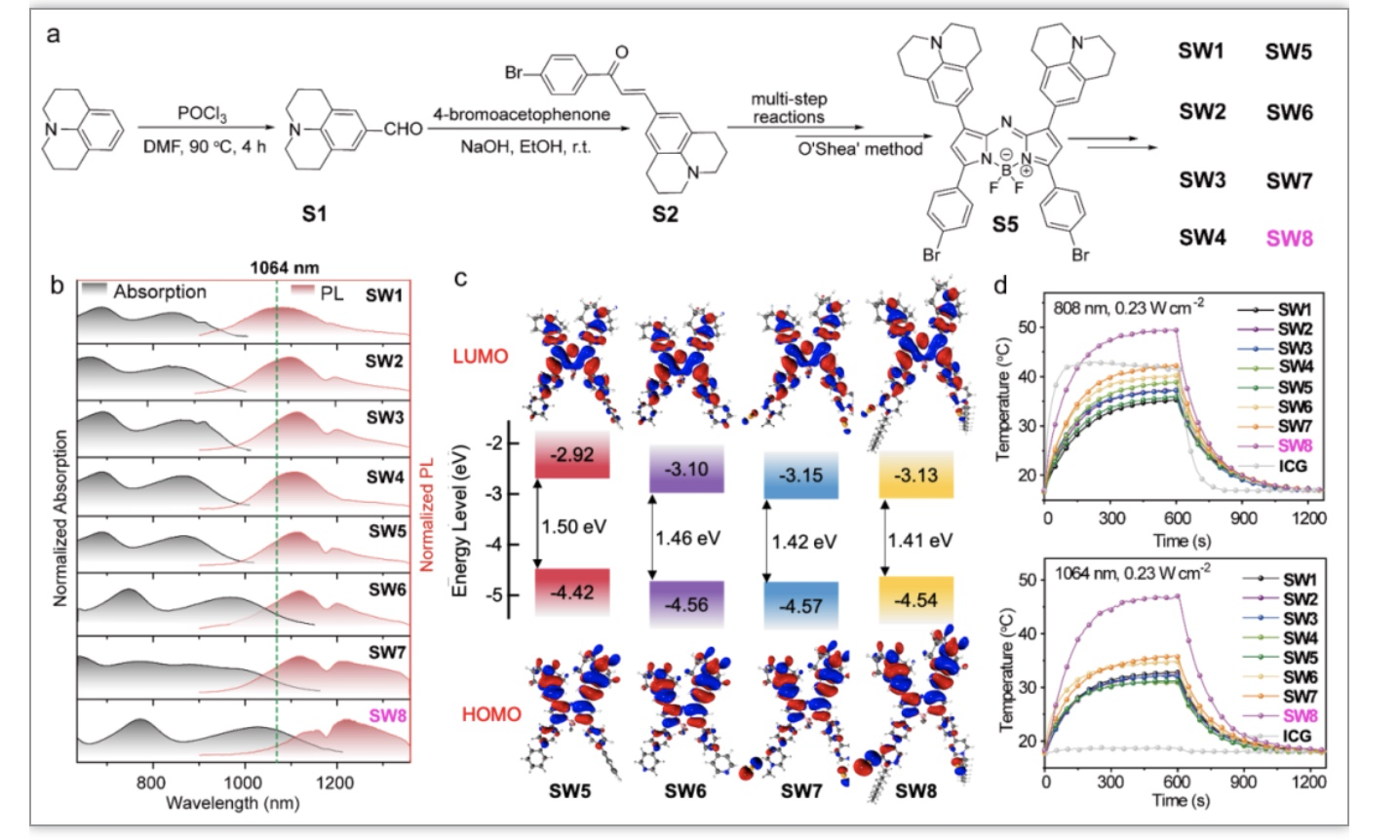
图2. SW1-8的合成及其光物理性质
选取吸收/发射波长最具优势的SW8进行纳米化自组装(图3a),将SW8封装到两亲性基质中形成水溶性纳米颗粒(SW8@NPs)。在1064 nm激光照射下,SW8@NPs的PCE高达75%(图3c),与SW1-7@NPs相比显著提高(图3d)。飞秒瞬态吸收光谱研究表明(图3f),SW8@NPs存在分子间非辐射衰减通道,其衰减速率高达1.3 × 1013 s-1,大约是传统分子内非辐射跃迁(如内转换)速率的100倍,这种超快的分子间非辐射跃迁是SW8@NPs具有超高PCE的主要原因。
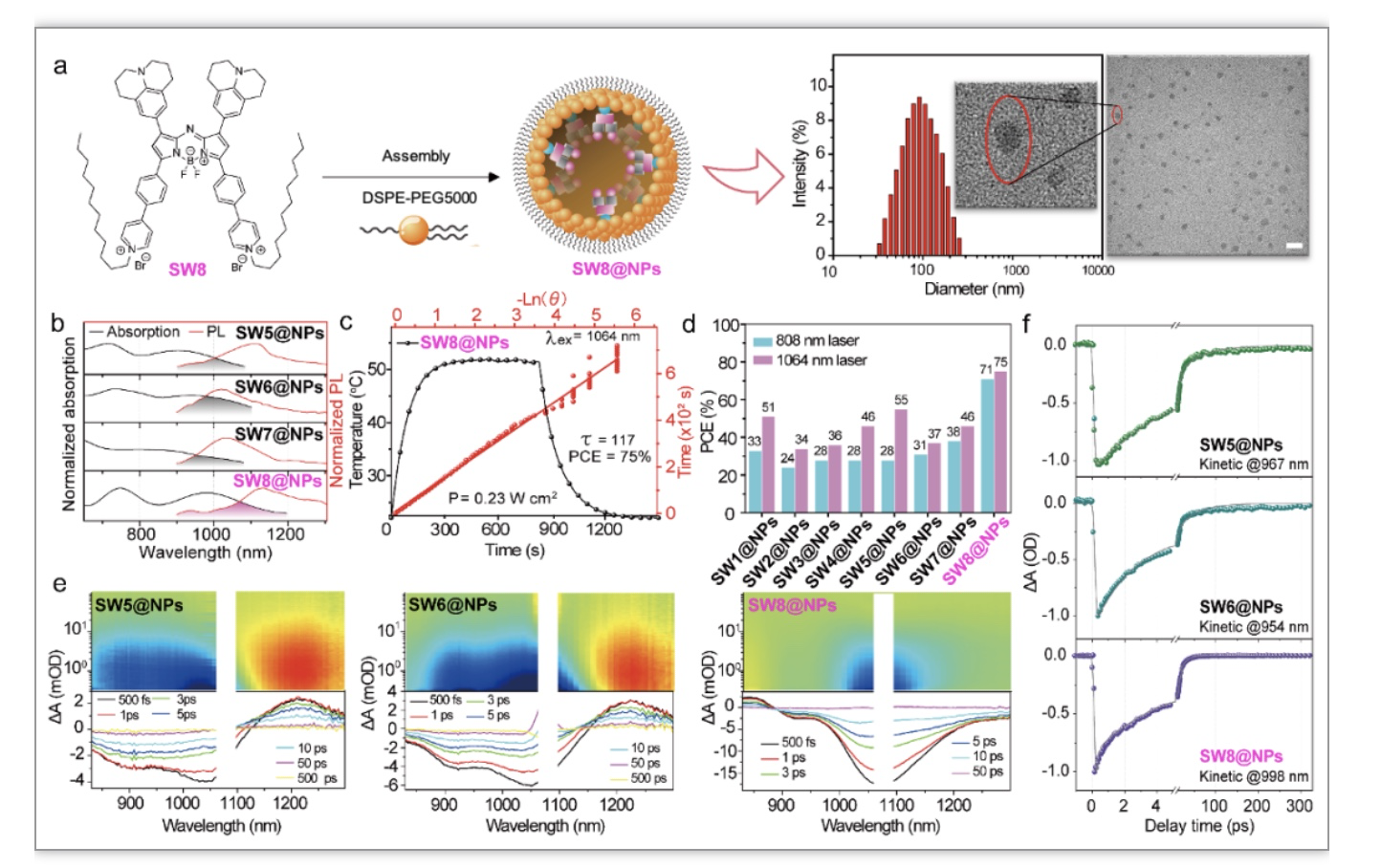
图3. SW1-8@NPs的制备、表征和光物理性质
为了研究SW8@NPs的生物相容性,文中采用SW8@NPs处理骨肉瘤细胞143B,结果表明,SW8@NPs能被细胞高效摄取,且暗毒性低、光毒性高,808 nm和1064 nm激光照射后能诱导细胞凋亡水平显著增加。且与808 nm激光相比,1064 nm光源能穿透15 mm厚的的肌肉组织,有效激发SW8@NPs产热(图4a)。在小鼠143B原位骨肿瘤模型中进一步研究表明,SW8@NPs在肿瘤部位蓄积度高(图4b)、光热效应强(图4c)。SW8@NPs尾静脉注射骨肿瘤小鼠,每2天注射1次,并在注射后24 h分别采用808 nm (0.33 W cm-2)和1064 nm (0.5 W cm-2)激光照射肿瘤部位10 min,X-ray成像监测原位肿瘤生长情况,12天后切除肿瘤组织,称重并做组织病理学和分子生物学分析。结果显示,在1064 nm激光照射下,SW8@NPs处理可显著抑制肿瘤的生长至观察终点(图5e,f)。而对照组和SW8@NPs+808 nm照射组肿瘤生长迅速,至观察终点时肿瘤体积、重量比SW8@NPs+1064 nm组平均增加4-5倍(图5g和5h)。
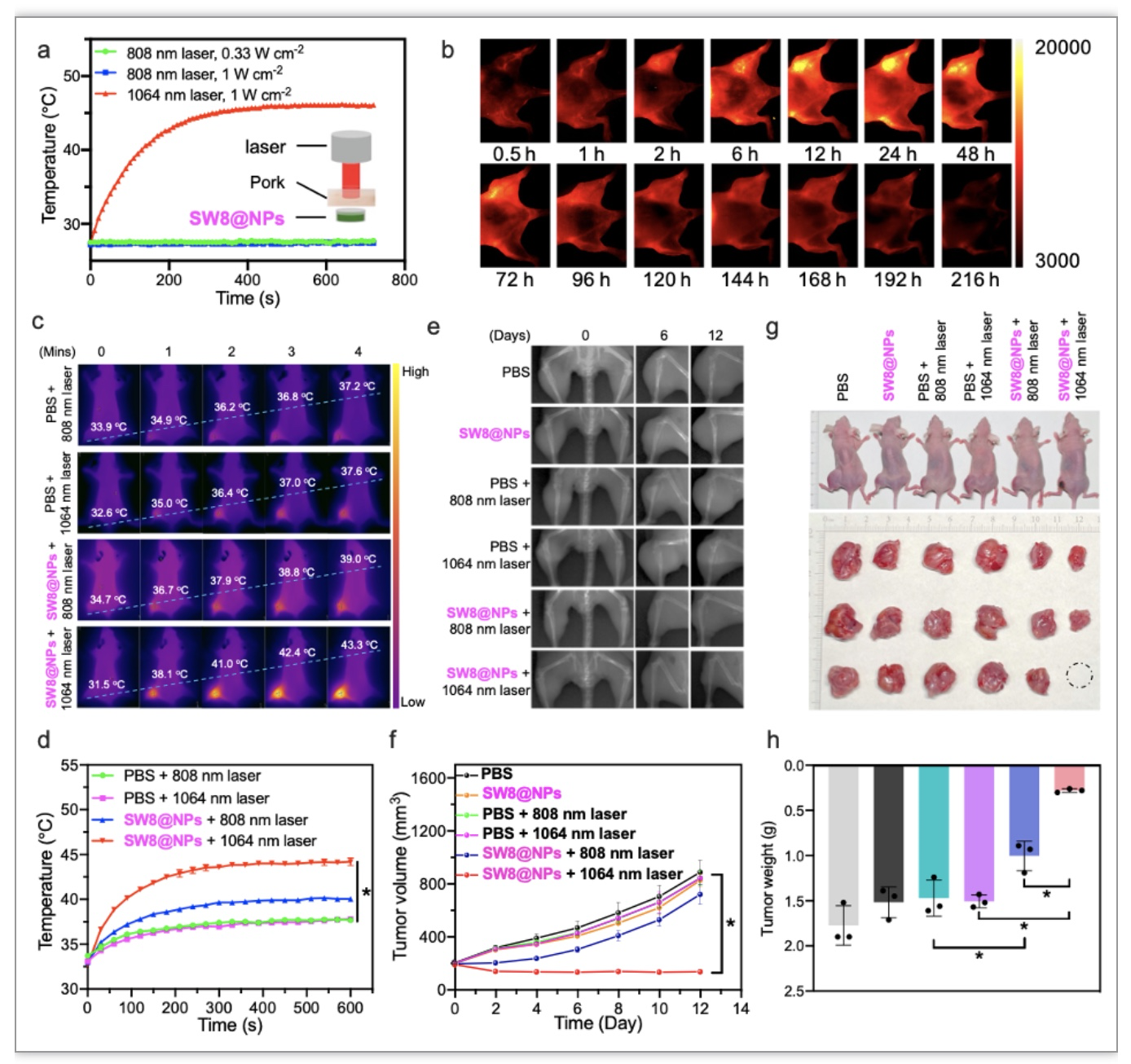
图4. SW8@NPs在808/1064 nm激光照射下的体内光热效应及小鼠骨肿瘤的光热治疗
组织病理学结果显示,SW8@NPs+1064 nm组肿瘤组织结构破坏严重,肿瘤实质细胞大量消失,呈空泡状,且TUNEL结果显示组织细胞凋亡水平显著增高(图5a)。凋亡通路相关蛋白(Bax、Bcl2、Caspase 3、Caspase 9和PARP1)的免疫印迹分析表明,SW8@NPs+1064 nm组凋亡蛋白整体磷酸化表达水平增高,凋亡激活(图5b,c)。另一方面,焦亡通路蛋白Caspase 1和Gasdermin D的磷酸化水平在SW8@NPs+1064 nm照射下也显著上调(图5b,d)。以上结果揭示了在1064 nm 激光诱导下,SW8@NPs通过协同调控凋亡、焦亡机制发挥抗肿瘤作用。
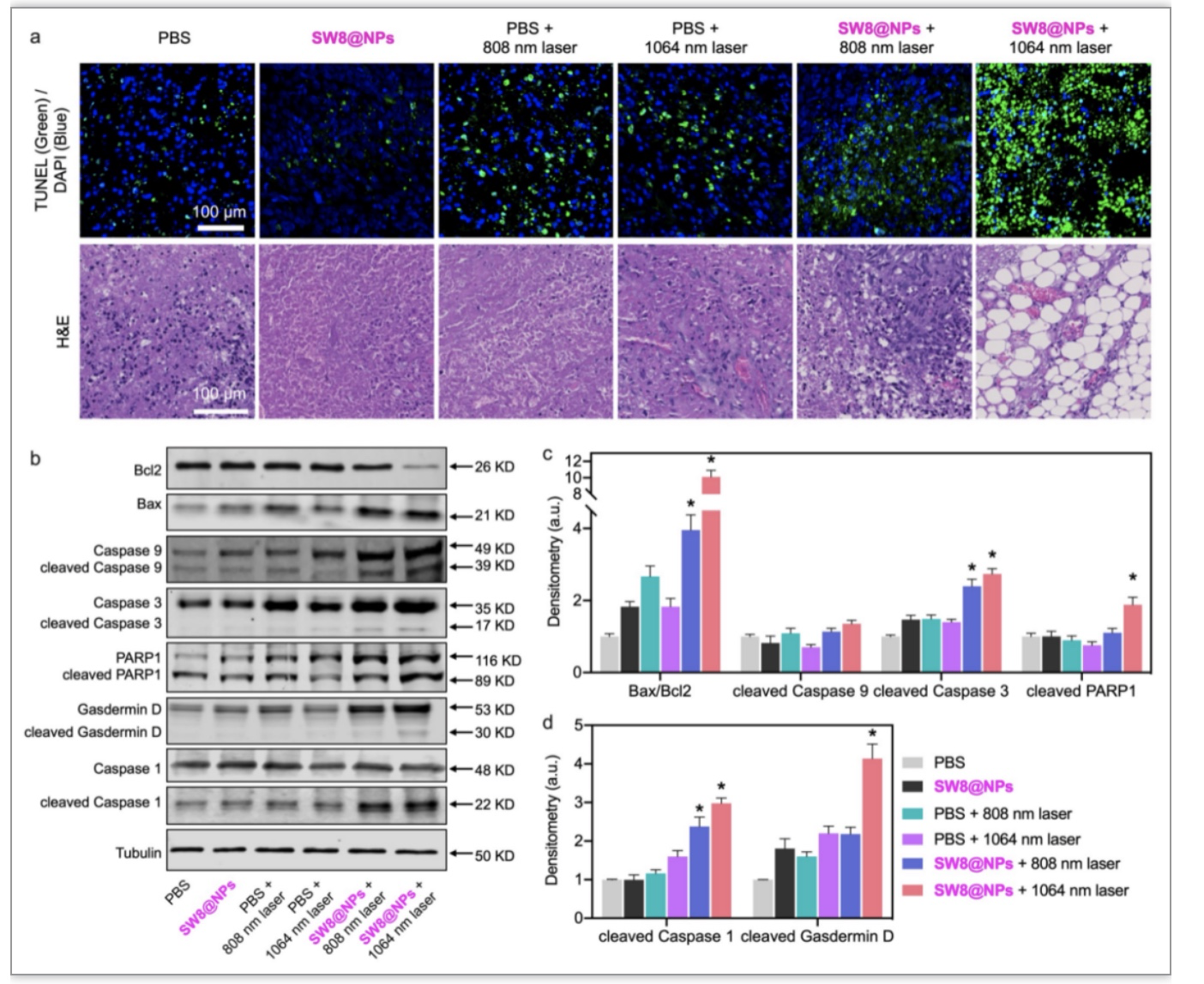
图5. 808/1064 nm激光照射下SW8@NPs对肿瘤组织凋亡、焦亡通路的影响
综上所述,本研究设计合成了一种新型有机小分子光热剂SW8,自组装成纳米颗粒后在NIR-II窗口下PCE可达75%。分子激发态动力学分析揭示,非辐射衰变途径是其具有超高PCE的光物理机制。经体内外生物模型验证,SW8@NPs在1064 nm激光照射下以协同诱导细胞凋亡/焦亡的方式有效甚至完全控制骨肿瘤生长,且无明显副作用。SW8纳米粒子作为NIR-II窗口的有机小分子光热剂不仅能抑制深部肿瘤的原位生长,且热损伤小,生物安全性高,在肿瘤光热治疗的临床应用中展现出巨大潜力。

