胶质瘤是一类常见的脑肿瘤,目前除了手术,放化疗以外,尚缺乏更多可选择的治疗手段。随着免疫治疗的蓬勃发展,为胶质瘤的治疗带来了新的希望,其中膜蛋白CD47对肿瘤免疫逃逸有着重要的影响,然而CD47在胶质瘤中表达调控的分子机制尚不明确。因此,深入认识并阐明CD47的表达调控机制有望为肿瘤的免疫治疗提供新策略。

该项研究表明了在胶质瘤中CD47的表达水平显著高于癌旁组织;在人胶质瘤细胞中,激活的EGFR增强了Src介导CD47的磷酸化,从而阻断了E3泛素连接酶TRIM21与CD47的结合,使CD47不被泛素化降解,引起CD47蛋白水平升高,造成肿瘤中浸润的巨噬细胞的吞噬功能受到抑制,最终促进肿瘤免疫逃逸。
先天性免疫系统为抵抗感染和抑制细胞恶性转化发挥着重要的作用。抗原递呈细胞,如单核细胞,树突状细胞和巨噬细胞通过吞噬作用来捕捉和消除恶性转化细胞,从而在先天性免疫系统中扮演重要的角色。更为重要的是抗原递呈细胞能作为“桥梁“将肿瘤来源的抗原呈递给T细胞,激活T细胞,从而激活下游的获得性免疫系统。但是肿瘤细胞则常通过高表达免疫检查点蛋白从而促进自身免疫逃逸。整合素相关蛋白(IAP或CD47),是一类高度糖基化的五次跨膜蛋白,常常在血液肿瘤或实体瘤中过表达,促使肿瘤细胞能逃避先天免疫系统监视。CD47能结合和激活信号调节蛋白a(SIRPa),SIRPa是一个在髓系细胞中(如巨噬细胞)中表达的抑制性分子。激活的SIRPa能启动一系列信号从而抑制巨噬细胞的吞噬活性。因此,CD47发挥着抗吞噬或“别吃我”信号从而使相应的细胞免受吞噬细胞对其的消除。目前使用CD47阻断抗体用于肿瘤治疗已进入了临床试验阶段。
CD47在转录水平的表达调控受到多个转录因子影响,包括STAT3,b-catenin/TCF4,HIF-1和c-Myc等。然而CD47分子在翻译后水平的调节,尤其是对肿瘤中常见异常激活的受体酪氨酸激酶(RTKs)的反应如何尚未明确。此外,干扰促癌信号影响CD47的表达,从而增强靶向RTK药物对肿瘤的疗效也没有相关的研究报道。
该项研究发现表明表皮生长因子受体(EGFR)的激活,能促使c-Src对CD47的288位酪氨酸(Tyrosine,Y)磷酸化,从而使CD47的稳定性增高。通过进一步研究发现E3泛素连接酶TRIM21能与CD47结合,并介导CD47第99位和102位赖氨酸(Lysine,K)的泛素化,造成CD47的降解,而EGFR激活后则能阻断上述效应,使CD47蛋白水平升高。通过小鼠胶质瘤动物模型实验发现CD47 Y286F突变(等同于人CD47 Y288突变为F)能显著的降低CD47的表达水平,增强巨噬细胞对肿瘤的吞噬能力,和抑制胶质瘤的生长,而CD47 K99/102R突变则出现了与上述完全相反的效应。更为重要的是,该团队的研究表明阻断CD47能有效的增强靶向EGFR药物对小鼠胶质瘤模型的治疗效果。
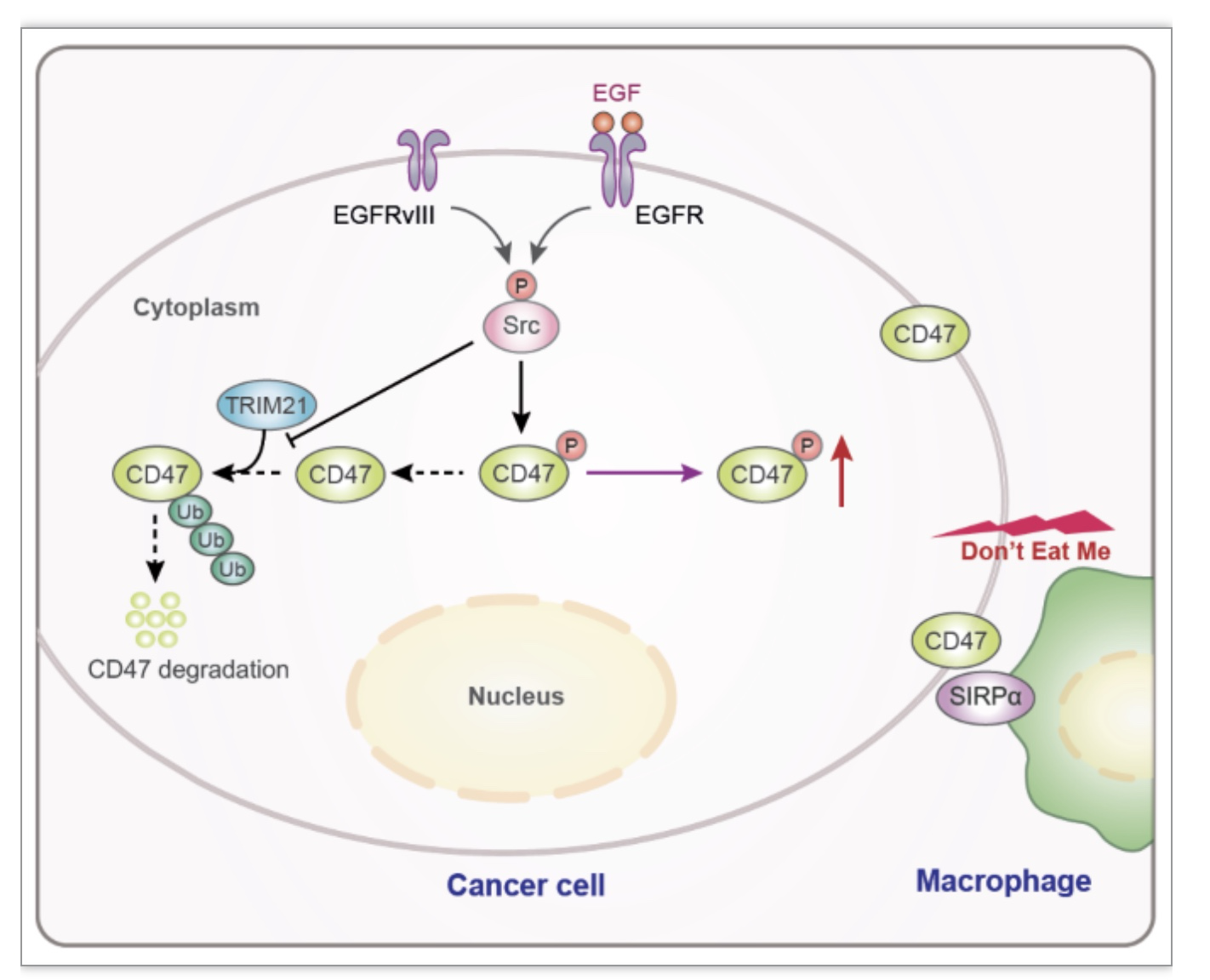
图1 模式图

