摘 要:RNA 干扰(RNA interference, RNAi) 是真核生物中高度保守的,由小分子干扰RNA (small interfering RNA, siRNA) 介导的转录后基因沉默现象,在基因功能的研究中得到了非常广泛的应用,并有望成为小核酸药物在疾病治疗中发挥重要作用。现对近年来RNAi 的作用机制、siRNA 的产生途径、引起RNAi 副作用的原因以及RNAi 表达载体的设计这四个方面的国内外研究进展进行了总结,对RNAi 与CRISPR 技术在应用中的关系进行了探讨,展望了RNAi 技术未来的发展。
关键词:RNAi ;siRNA ;RNAi 表达载体;Ago2 ;基因沉默;脱靶效应
中图分类号:Q52 ;Q789 文献标志码:A
Mechanism and application of RNA interference
SHANG Ren-Fu , WU Li-Gang*
(State Key Laboratory of Molecular Biology, Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200031, China)
Abstract: RNA interference (RNAi) is an evolutionarily conserved post-transcriptional gene silencing mechanism mediated by small interfering RNA (siRNA) in eukaryotes, which has become a powerful tool to silence gene and holds great promising for combating human diseases. This review summarizes the current knowledge about the mechanism of RNAi, off-target effects and designing of siRNA-expressing vectors. We also compare the RNAi with CRISPR technology and further discuss the prospect of its future applications.
Key words: RNA interference; siRNA; RNAi vectors; Ago2; gene silencing; off-target effect
RNA 干扰(RNA interference, RNAi) 是真核生物中由小干扰RNA (small interfering RNA, siRNA)所介导的转录后基因沉默现象,在调控基因表达、防止基因组中逆转座元件扩增和抵御病毒入侵等方面具有重要功能。RNAi 现象最初发现于秀丽线虫中[1],此后的研究表明RNAi 在果蝇、拟南芥、斑马鱼和哺乳动物等真核生物中都高度保守。由于RNAi 可特异性地抑制靶基因的表达,操作简易,使用成本低,既能灵活组合同时抑制多个靶基因,又能用于大规模的基因筛选[2],在探索基因功能以及作为小分子核酸类药物进行疾病治疗中都具有巨大的应用潜力[3-4]。2006 年的诺贝尔生理学或医学奖也因此授予了发现RNAi 现象的Craig Mello 和Andrew Fire 教授。
1 RNAi的作用机制
siRNA 是介导RNAi 现象的关键分子,由长度约为21 个碱基的两条小RNA 组成,其中与靶标RNA完全互补配对的一条siRNA链为guide链(guide strand), 另一条siRNA 链为passenger 链(passenger strand)。guide 链和passenger 链之间有19 个碱基互补配对,在双链siRNA 两端各形成2 个碱基的3′末端悬垂。外源导入或细胞内加工生成的siRNA 在细胞质内与Argonaute (Ago) 等蛋白质因子结合,形成RNA 诱导的沉默复合体(RNA-induced silencing complex, RISC)。RISC 复合物中通常只有一条siRNA 链被保留,另一条链大部分被丢弃并降解,这种链选择性主要取决于双链siRNA 5′ 末端碱基配对的热力学稳定性,5′ 末端碱基配对相对不稳定的那条链更倾向于被RISC 保留[5-6]。siRNA 通过碱基互补配对识别靶标RNA,在镁离子和ATP 的参与下,Ago 利用其核酸内切酶活性切割与siRNA 完全互补配对的靶标RNA,产生的RNA 片段易受到5′ 或3′核酸外切酶的攻击而快速降解,从而在转录后水平沉默靶基因的表达[7-8]。
Ago 是RISC 复合物中的核心蛋白质,结合siRNA 并切割靶基因的RNA。Ago 蛋白的结构在进化中高度保守,主要由PAZ、MID 和PIWI 三个特征结构域组成[9-10]。其中,PAZ 结构域结合siRNA 3′ 末端;MID 结构域特异性结合siRNA 5′末端,尤其偏好U 和A 碱基[11] ;PIWI 结构域包含类似RNase H 的结构,具有核酸内切酶活性,如哺乳动物的Ago2 蛋白[12]。在不同物种中,Ago 家族成员的数目有显著差异:裂殖酵母中仅有1 种,线虫中多达27 种,果蝇中有2 种(Ago1 和Ago2),包括人类在内的哺乳动物表达4种Ago蛋白质(Ago1~4),但其中只有Ago2 具有核酸内切酶活性[13-14]。另外,siRNA 还需要细胞内的TRBP 等蛋白质的协助才能以正确的方式高效地进入RISC 复合物,并组装形成具有活性的RNAi 分子机器[15]。
2 siRNA的产生途径
siRNA 和Ago2 是RNAi 分子机器RISC 中最重要的两个组分,如果将Ago2 比喻为锋利的分子剪刀,siRNA 就是提供靶位点序列信息的导向标(guide)。在体外重组实验中,仅仅加入siRNA 和Ago2 就足以对靶标RNA 进行切割。siRNA 主要由四种方式产生:长的双链RNA (double strand RNA, dsRNA) 加工生成、直接通过化学方法合成、RNA聚合酶III 启动子转录产生、RNA 聚合酶II 启动子转录产生。在线虫中首次发现的RNAi 现象就是由dsRNA 在细胞质内被RNase III 家族的核酸酶Dicer切割产生的siRNA 所介导。虽然dsRNA 可以在植物以及线虫、果蝇等低等动物中高效地诱发RNAi,但在哺乳动物中dsRNA 只能用于在胚胎干细胞中诱导RNAi。这是由于在其他类型细胞中,大于30bp 的dsRNA 会激活细胞的抗病毒及干扰素反应,如PKR 和RNase L 途径( 胚胎干细胞中该途径被关闭),导致细胞的迅速凋亡[16],因而dsRNA 的应用范围受到限制。为了解决这个问题,研究人员通过转染直接将化学方法合成的21 bp 的双链siRNA 导入哺乳动物体细胞,成功实现了对靶基因的沉默作用[17-18]。由于该方法较为方便快捷,很快获得了广泛应用。由于siRNA 易被细胞内核酸酶降解,并会随细胞的分裂而被不断稀释,故其发挥功能的持续时间较短。虽然硫代和甲基化等化学修饰能够显著提高siRNA 在体内的稳定性[19],但成本高昂,并且仍然会随着细胞的生长和分裂而被稀释和代谢,加之很多原代细胞难以被转染,因此siRNA 在应用中仍有一定局限。
为了在细胞内长期稳定地表达siRNA,研究人员开发出了由细胞内RNA 聚合酶III 启动子( 如H1、U6 等) 驱动转录产生的siRNA 前体—shRNA (short hairpin RNA)[20-21]。目前广泛使用的shRNA包含一段长4 nt 的顶端单链环结构,以及长度为21~25 bp 的双链配对区,转录产生后在Ran-GTP的协助下由核质转运蛋白Exportin-5 识别并运出细胞核,在细胞质中被Dicer 及其协助蛋白TRBP 等识别并切割,产生约21 bp 的成熟双链siRNA 分子并发挥调控功能。shRNA 表达框架可构建在慢病毒、腺病毒和腺相关病毒等多种病毒载体上,能够在包括原代细胞在内的绝大多数组织和细胞类型中沉默靶基因[22]。
近来科研人员还开发了基于miRNA 前体的siRNA 表达载体。miRNA 是一类长度约为22 nt 的内生小分子RNA,广泛存在于动植物细胞中,调控超过60% 的蛋白质编码基因的表达[23]。大多数miRNA 基因首先由RNA 聚合酶II (Pol II) 转录产生长度为几百到几万个碱基的带有5′ 端帽子和3′端多聚腺苷酸(poly(A) tail) 尾的初始miRNA 前体(primary miRNA, pri-miRNA)。Pri-miRNA 在细胞核内被RNase III 蛋白质家族的Drosha 及其协助蛋白DGCR8 识别并切割生成长度约70 nt 的前体miRNA(precursor miRNA, pre-miRNA),Exportin-5 识别premiRNA的3′ 末端两个碱基的悬垂结构并将其运输到细胞质中,由Dicer/TRBP 进一步切割去除顶端单链环,产生长度约22 bp 的双链miRNA,其中5′末端碱基配对相对不稳定的那条链会进入RISC 发挥功能[24]。与siRNA 介导切割与之完全互补配对的靶标RNA 不同,成熟的miRNA 与靶标mRNA之间主要是通过miRNA 的种子区(seed region,也就是miRNA 的2~7 位碱基) 互补配对,由Ago 招募TNRC6 和CCR4-NOT 复合物介导mRNA 的翻译抑制和加速降解,进而影响该基因的表达[25-26]。由于siRNA 和miRNA 在长度、结构、加工途径和结合的蛋白质上都较为类似,研究人员基于miRNA的产生途径,将pri-miRNA 中的miRNA 序列替换成siRNA 序列, 通过RNA 聚合酶II 启动子( 如CMV、EF1) 转录产生类似pri-miRNA 结构的siRNA前体,被细胞核内的Drosha 及细胞质中的Dicer 进行连续切割并产生成熟的siRNA,同样可有效沉默靶基因的表达。这种基于miRNA 前体的RNAi 载体被称为shRNAmir[27-28]。相对于Pol III 启动子的高效性,使用Pol II 启动子优点是能够选择不同组织特异性的启动子表达siRNA,如肝脏特异性的启动子IGF II、Alb,或神经组织特异性的启动子NSE、GFAP 等,从而达到组织特异性沉默靶基因的目的。此外,利用各种诱导型启动子,如四环素诱导的Tet 启动子[29] 或光调控的启动子[30],可以实现由小分子化合物或光诱导的基因沉默,更为灵活。
3 RNAi的脱靶效应
RNAi 技术作为一种功能强大的基因调控工具,其固有的缺点随着其广泛应用逐渐显露。其中,最早引起关注的是RNAi 的脱靶效应(off-target)。siRNA通过与靶基因RNA 完全互补配对实现特异性沉默靶基因的表达(on-target)。若siRNA 与其他RNA上的碱基发生部分互补配对(siRNA 的2~7 位碱基与RNA 互补配对),则siRNA 以类似miRNA 的作用方式抑制mRNA 的翻译并加速其降解,非特异性抑制靶基因以外其他基因的表达,这种现象被称作RNAi 的脱靶效应 [31-32]。此外,在哺乳动物中不具有切割活性的Ago 家族成员(Ago1、Ago3、Ago4)也能够结合siRNA,它们介导脱靶效应的能力甚至比Ago2 更强[33]。研究表明,siRNA 可能会对细胞内几十到几百个基因的表达产生影响[31,34-35],导致对靶基因功能的错误解读。
双链siRNA 分子中除guide 链外,passenger链也会产生脱靶效应。虽然在设计时通过改变双链siRNA 5′ 末端碱基配对的稳定性可以提高guide 链保留的比例,但仍有部分passenger 链被保留下来并产生脱靶效应。另外,越来越多的研究发现,细胞中大量基因存在反义链转录本(antisense transcript)[36-38],这些反义链RNA 通过调控转录或改变正义链RNA的稳定性等方式影响正义链基因或其他基因的表达[39-40]。例如,P15 ( 又名CDKN2B) 基因的反义链P15-AS ( 又名ANRIL) 通过结合某些蛋白质抑制P14、P15 和P16 等抑癌基因的表达,从而促进前列腺癌等癌症的发展[41-42]。因此,当siRNA 的guide链沉默正义链RNA 时,其passenger 链可能会沉默其反义链RNA,导致在运用RNAi 技术研究存在反义链RNA 的基因时产生实验假象。
4 对细胞内源miRNA的竞争抑制
RNAi 载体表达siRNA 时对细胞内源miRNA加工和功能的竞争抑制也可造成毒副作用。不论是Pol III 启动子转录产生的shRNA 或Pol II 启动子转录产生的shRNAmir, 它们在加工产生成熟的siRNA 时都需要利用细胞内源的Drosha、Dicer 和Exportin-5 等蛋白质因子,这些蛋白质也是细胞内miRNA 加工成熟所必需的因子,因此,在细胞内过表达shRNA 时必然对miRNA 的加工造成竞争作用。即使是化学合成的双链siRNA,转到细胞内也会与内源miRNA 竞争与Ago 蛋白的结合,从而影响miRNA 的表达和功能[43]。在小鼠肝脏中长期高表达shRNA 会造成肝损伤并致死,其主要原因就是过量的shRNA 竞争Exportin-5 和Ago2 等蛋白质,影响了小鼠肝脏内源miRNA 的表达和调控功能,导致miRNA 靶基因的表达上调[44-45]。由于这种竞争作用对细胞内几乎所有miRNA 的加工和功能都造成影响,其引发的生理效应在不同的组织细胞中极为复杂。因此,如何既能实现对靶基因的高效抑制,同时又能将对细胞内源miRNA 的影响降到最低,成为RNAi 载体设计的挑战之一。
5 安全高效RNAi载体的探索
利用siRNA 或shRNA 文库进行大规模功能性筛选时,RNAi 沉默效率低可导致假阴性结果,而脱靶效应和对内源miRNA 的竞争往往会造成假阳性结果,这些因素都会对后期的实验验证和功能研究造成困扰。临床治疗中RNAi 的效率和副作用直接决定了siRNA 药物的成效和使用成本。研究表明,RNAi副作用与shRNA抑制靶基因的效率密切相关。低效shRNA 对靶基因表达的抑制不完全,需使用更多的shRNA,引起更严重的脱靶效应和对内源miRNA 的影响,结果导致细胞生长抑制或死亡[44]。因此,如何最大限度地提高效率和减少副作用是RNAi 应用研究中最重要的问题之一。
对siRNA 中特定位置的核苷酸进行化学修饰可以提高其稳定性,降低脱靶效应[46]。有关siRNA链内部化学修饰的报道较少,大多数修饰是针对靠近siRNA 3′ 或5′ 端的核苷酸,如硫代和甲基化,以增强对细胞内核酸酶的抵抗能力或改变其碱基配对的热力学稳定性。由于化学修饰种类多,可修饰的位点和效果不明确,加上合成成本高昂,目前主要由少数大型制药和生物技术公司在进行研发。经过化学修饰的单链siRNA 可在动物体内介导RNAi,该方法消除了passenger 链造成的脱靶效应[47-48]。然而,由于单链siRNA 并非Ago2 识别的天然底物,其结合Ago 并进入RISC 复合物的效率较低,部分转入细胞的单链siRNA 很可能直接通过部分碱基互补配对与细胞内RNA 结合,以反义寡核苷酸(antisense oligo) 的方式影响某些RNA 的功能,其引发的副作用有待继续研究观察。
优化siRNA 表达载体的设计是提高RNAi 效率和降低副作用的有效方法。例如,在设计shRNA载体时,将位于3′ 链上的成熟siRNA 序列与顶端环之间的距离固定为两个碱基,可大幅提高Dicer加工shRNA 的精确度,产生的siRNA 具有更准确的5′ 末端,从而避免了由于生成的siRNA 序列的异质性所带来的脱靶效应[49]。近期,一类短双链区的新型RNAi 载体(sshRNA、AgoshRNA 或saiRNA)受到广泛关注[50-52]。相较传统含21~25 bp 双链区的shRNA, 新型RNAi 载体双链区长度仅为16~18bp,顶端环大小为3~8 nt,且顶端环越小其对靶基因的抑制效率越高[52]。这类短茎环结构的新型siRNA前体在细胞内由Pol III 启动子转录并出核后,不经过Drosha 和Dicer 的加工,直接被Ago2 蛋白识别并在茎环结构3′ 链上第8~9 位碱基处切割,切割产物的3′ 端在细胞内被外切核酸酶进一步切短,最终形成长度为24~27 nt 的单链siRNA,明显长于经典的21 nt 的siRNA,但同样能以RNAi 的方式沉默靶基因( 图1)。这种依赖于Ago2 的加工途径类似于在斑马鱼和哺乳动物中保守的一种特殊miRNA 前体——pre-miR-451 的加工步骤[53-55]。进一步在saiRNA (single-stranded Ago2-processed interferingRNA) 的3′ 末端连接经过改造的丁型肝炎病毒(hepatitis delta virus, HDV) 核酶(ribozyme),利用该核酶的高效自切割活性准确地在saiRNA 的3′ 端产生两个碱基悬垂,明显促进了其与Ago2 的结合,显著提高了基因沉默的效率[52]。有趣的是,saiRNA所产生的siRNA 量远低于传统的shRNA,但对靶基因却有同样甚至更高的抑制效率,即单位分子的siRNA 对靶基因的沉默效率更高。而saiRNA 依赖于Ago2 内切酶活性的特殊加工方式避免了成熟的siRNA 进入无切割活性的Ago1、Ago3 和Ago4 所引起的脱靶效应,同时也大幅降低了对细胞内源miRNA 的竞争作用[52,56-57]。另外,saiRNA中的passenger 链在加工过程中被Ago2 切断并降解,完全消除了该链带来的脱靶效应( 图1),进一步减少了副作用。
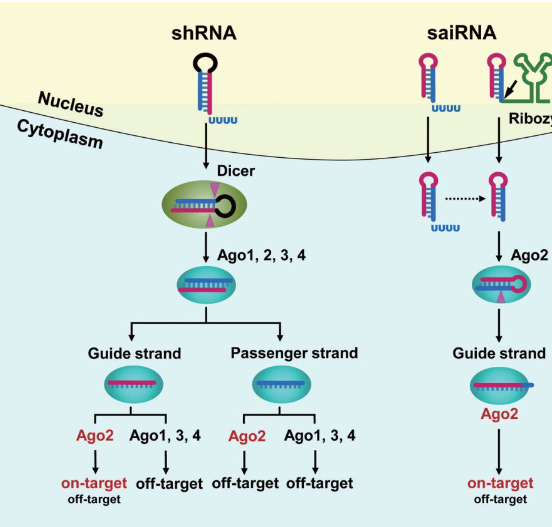
shRNA被细胞内的Dicer识别加工后产生双链siRNA,其guide链(guide strand)和passenger链(passenger strand)都能被细胞内的Ago1~4所结合,但只有Ago2才能介导与guide链完全互补配对的靶基因RNA的切割和沉默作用(on-target),而与guide链结合的Ago1、3、4,以及与passenger链结合的Ago1~4都会引起脱靶效应(off-target)。saiRNA可直接被Ago2识别并加工,其特殊的加工过程避免了产生passenger链及其脱靶效应,而且只有与Ago2结合的saiRNA才能产生guide链发挥on-target效应,从而大大减少了其他Ago引起的off-target效应。saiRNA转录后通常具有较长的3′端悬垂,不能被Ago2直接识别。通过在saiRNA的3′末端融合一个自切割J型肝炎病毒(HDV)核酶,精确产生具有2个碱基的3′端悬垂,大大促进了saiRNA与Ago2的结合效率,从而显著提高了saiRNA的沉默效率。
图1 shRNA和saiRNA加工及作用机制示意图
siRNA 和shRNA 序列的选择规则也有极大的提升空间。未经优选的shRNA 对靶基因的抑制效率较低,通常需设计3~5 条shRNA 以保证其中1~2条能对靶基因达到70% 以上的沉默效率[58-59],要获得沉默效率超过90% 的shRNA 则必须进行大量的筛选。Gregory Hannon 实验室建立了基于高通量克隆和深度测序的筛选系统,证实“超级”shRNAmir存在的比例仅为几百分之一,每个细胞的基因组中只需整合一个拷贝的“超级”shRNAmir 即能实现对靶基因高达90% 以上的抑制效率[59]。然而,目前除了一些基本的设计规则,尚无有效的通用算法能预测siRNA 和shRNA 的效率,逐个构建克隆和测试的“try and error”方法显然难以在短时间获得全面的信息。因此,未来需要以结构生物学为指导,结合高通量筛选方法,通过生物信息学分析和机器学习总结规律,实现siRNA 和shRNA 的理性设计。另外,其他类型小RNA 加工机制的研究成果可用来启发新型RNAi 载体的设计,如细胞内存在大小类似于pre-miRNA 的内含子,在被剪接复合体剪切下来后跳过了Drosha 加工的步骤,直接被Dicer 识别并加工产生成熟的miRNA,称为mirtron[60-61]。因此,随着对各种小RNA 加工和沉默机制的深入研究,对siRNA 序列设计规则的经验积累,以及各类新型病毒载体的不断创新,RNAi 载体将越来越安全和高效。
6 总结及展望
近几年CRISPR 和TALEN 等基因组编辑技术的出现使得复杂费时的基因敲除变得简单易行[62-65],在基因功能的研究中得到广泛应用,难免使人对RNAi 技术的未来发展产生困惑。我们认为CRISPR和RNAi 各有所长,今后将会长期共存,在各自擅长的领域发挥重要作用。CRISPR 技术的优势是能永久性地改变基因组DNA 的序列,但在基因沉默方面RNAi 技术有其独特的优势。(1) RNAi 无需引入额外的蛋白质因子,更安全,成本更低。RNAi依赖细胞内源的RISC 发挥功能,除siRNA 外无需引入其他因子。而CRISPR 需同时转入Cas9 蛋白和sgRNA,这不仅增加了投递技术的难度,Cas9还可能引发人体的免疫反应和其他意想不到的副作用。(2) RNAi 是一种转录后水平的可逆的基因沉默技术,只需通过siRNA 的添加与否,或使用小分子化合物调控siRNA 表达载体上诱导型启动子的活性就能实现对靶基因的沉默与开启。CRISPR 对基因的关闭作用是不可逆的,并且同样存在脱靶效应[66-68],但由于CRISPR 改变的是DNA 序列,这种不可逆的脱靶效应所导致的后果可能更严重。虽然CRISPRa或CRISPRi 技术能够实现可逆的基因表达操作,但需引入额外的转录调控因子,由此导致的副作用尚有待进一步研究。(3) RNAi 沉默基因见效更快。在细胞水平上RNAi 沉默基因的效果只需2~3 天就能显现,而CRISRP 通常需要5~7 天,有时还需进行单克隆细胞的筛选和扩增,对研究细胞生长或生存必需基因的功能造成一定困难。此外,很多人类疾病源于基因表达水平的变化,而非基因的丢失或关闭,RNAi 是更为适合的研究手段。(4) RNAi 在转录后水平调节基因的表达,故设计siRNA 时只需参考转录组数据。CRISPR 在基因组和转录水平调节基因表达,设计sgRNA 以及预测脱靶效应时需参考基因组数据,但现有基因组序列的很多区域注释不完善,且沉默效果受到染色体高级结构的影响。因此,研究人员在选择应用基因沉默技术时应针对上述特点加以考量[69]。
RNAi 技术在动植物中都具有广泛的应用前景。例如,RNAi 可用于防治植物病虫害。在植物中转入针对特定种类有害昆虫的生长必需基因的RNAi载体,当害虫摄取植物茎叶时同时摄入了siRNA,从而特异地抑制害虫生长相关基因的表达[70]。在植物中表达siRNA 也可以直接用于调控作物本身抗逆和产量等农艺性状相关基因的表达,从而大幅提高农作物的产量和品质。在人类疾病治疗方面,越来越多的生物技术和制药公司加入了对RNAi 药物的研发,包括针对呼吸道合胞体病毒感染(respiratorysyncytial virus infection)、湿性年龄相关性黄斑变性 病症(wet age-related macular degeneration) 和乙型肝炎(hepatitis B) 等在内的几十种疾病的siRNA 治疗药物已经分别进入一到三期临床试验[71]。2014 年以来,国际大型制药企业对RNAi 生物技术公司的并购活动日益活跃,如罗氏制药公司(Roche) 以4.5亿美元收购丹麦的RNAi 专业研究公司Santaris,重启RNAi 药物研究;赛诺菲公司投资7 亿美元收购Ainylam 公司约12% 的股份以支持其在RNAi 领域的研究。预期未来3~5 年内基于RNAi 技术的新药或新疗法就可能上市,引领继抗体药物之后的新一轮药物创新热潮。总之,通过提高RNAi 载体的效率,降低其毒副作用,以及改进投递方法,RNAi技术必将在今后的科学研究和疾病治疗中继续大放异彩。

